ecosistemas
ISSN 1697-2473
Open access / CC BY-NC 4.0
© 2025 Los autores [ECOSISTEMAS no se hace responsable del uso indebido de material sujeto a derecho de autor] / © 2025 The authors [ECOSISTEMAS is not responsible for the misuse of copyrighted material]
Ecosistemas 34(3): 2915 [septiembre-diciembre / September-December, 2025]: https://doi.org/10.7818/ECOS.2915
MONOGRÁFICO: Ecología de las invasiones / MONOGRAPHIC: Invasion Ecology
Editores invitados / Guest editors: Jonatan Rodríguez y Luis González
ARTÍCULO DE INVESTIGACIÓN / RESEARCH ARTICLE
¿Se fragmenta la supercolonia? Diferencias morfológicas y de comportamiento entre poblaciones insulares y continentales de la hormiga argentina (Linepithema humile)
Blanca María Fraga-Cimadevila1 ![]() ,
Adolfo Cordero-Rivera1
,
Adolfo Cordero-Rivera1 ![]() , Iago Sanmartín-Villar1,2,*
, Iago Sanmartín-Villar1,2,* ![]()
(1) Universidade de Vigo, ECOEVO Lab, Escola de Enxeñaría Forestal, Campus A Xunqueira, 36005 Pontevedra, Galiza, España.
(2) ADIBECO, Departamento de Biodiversidad y Gestión ambiental, Universidad de León, 24071 León, España.
* Autor para correspondencia / Corresponding author: I. Sanmartín-Villar [isanv@unileon.es]
|
> Recibido / Received: 21/11/2024 – Aceptado / Accepted: 01/08/2025 |
Cómo citar / How to cite: Fraga-Cimadevila, B.M., Cordero-Rivera, A., Sanmartín-Villar, I. 2025. ¿Se fragmenta la supercolonia? Diferencias morfológicas y de comportamiento entre poblaciones insulares y continentales de la hormiga argentina (Linepithema humile). Ecosistemas 34(3): 2915. https://doi.org/10.7818/ECOS.2915
|
¿Se fragmenta la supercolonia? Diferencias morfológicas y de comportamiento entre poblaciones insulares y continentales de la hormiga argentina (Linepithema humile) Resumen: La introducción de la hormiga argentina (Linepithema humile) ha creado un escenario ecológico y evolutivo sin parangón que ha permitido a esta especie la colonización de cinco continentes en poco más de cien años. Se ha asumido que el éxito invasor de esta especie radica en la ausencia de competencia intraespecífica producto del efecto fundador y cuello de botella que ha permitido su expansión como una única identidad social. Sin embargo, a medida que se han realizado más estudios, se ha observado que la interacción entre colonias introducidas no es tan homogénea como se asumía, descubriéndose entre ellas diferentes grados de competencia. Con el fin de desentrañar si esta competencia incrementa en ambientes aislados geográficamente, analizamos la distribución y la variabilidad de colonias insulares y continentales. Detectamos la presencia de hormiga argentina en tres de las 11 islas visitadas. Con el fin de analizar la variación de rasgos fenotípicos relacionados con el potencial invasor y los procesos adaptativos, se compararon la morfología y el comportamiento (locomoción, tigmotaxis) de las hormigas obreras insulares (N=3 colonias) con las de colonias continentales cercanas (N=3) y distantes y con las de otro grupo genético (sur, N=2). Como índice de competencia intraespecífica se comparó la tasa de mortalidad en enfrentamientos entre obreras de las colonias muestreadas. Las colonias insulares y continentales mostraron diferencias en la distancia entre ojos y de comportamiento, pero las diferencias no siguieron un patrón general. Se detectó una escasa mortalidad en enfrentamientos entre obreras de colonias de diferentes islas u hormigas insulares y pertenecientes a colonias continentales distanciadas, pero se registró hasta un 64 % de mortalidad cuando se pusieron en contacto obreras insulares con las de las colonias continentales más cercanas. La mortalidad entre estas hormigas superó la encontrada en el resto de las combinaciones salvo en el enfrentamiento de hormigas insulares y las del grupo genético sur. Explicamos los resultados observados como el producto combinado de la evolución divergente entre poblaciones del grupo genético norte tras la colonización de las islas y la adaptación a sus condiciones locales y el efecto de las “vecinas molestas”. Palabras clave: agonismo; islas atlánticas; control de especies invasoras; Galiza; insectos sociales; vecinas molestas Is the supercolony fragmenting? Morphological and behavioural differences between insular and continental populations of the Argentine ant (Linepithema humile) Abstract: The introduction of the Argentine ant (Linepithema humile) has created an unparalleled ecological and evolutionary scenario that has allowed this species to colonize five continents in just over a hundred years. It has been assumed that the invasive success of this species lies in the absence of intraspecific competition resulting from the founder effect and bottleneck that has allowed its expansion as a single social identity. However, as more studies have been conducted, it has been observed that the interaction between introduced colonies is not as homogeneous as assumed, with different degrees of competition being discovered among them. To determine whether this competition increases in geographically isolated environments, we analysed the distribution and variability of island and mainland colonies. We detected the presence of Argentine ants on three of the 11 islands visited. To analyse the variation in phenotypic traits related to invasive potential and adaptive processes, we compared the morphology and behaviour (locomotion, thigmotaxis) of island worker ants (N=3 colonies) with those of nearby (N=3) and distant continental colonies and with those of another genetic group (south, N=2). As an index of intraspecific competition, the mortality rate in confrontations between workers from the sampled colonies was compared. The island and mainland colonies showed differences in distance between eyes and behaviour, but the differences did not follow a general pattern. Low mortality was detected in confrontations between workers from colonies on different islands or between island ants and those belonging to distant continental colonies, but mortality of up to 64% was recorded when island workers came into contact with those from the nearest continental colonies. Mortality among these ants exceeded that found in the other combinations except in the confrontation between island ants and those from the southern genetic group. We explain the observed results as the combined product of divergent evolution among populations of the northern genetic group after colonization of the islands and adaptation to local conditions, and the effect of nasty neighbours. Keywords: agonism; Atlantic islands; invasive species control; Galiza; social insects; nasty neighbours |
Introducción
La invasión de especies exóticas representa uno de los mayores y más rápidos impactos ecológicos (p. ej. Roy et al. 2023; Pyšek et al. 2020) y económicos (p. ej. Diagne et al. 2021; Ahmed et al. 2023) de las últimas décadas, produciendo el desplazamiento y extinción de especies nativas (p. ej. Sax y Gaines 2008; Pyšek et al. 2017) y consecuentemente, alterando los servicios ecosistémicos y la contención de enfermedades (p. ej. Adla et al. 2022). Las consecuencias de estas invasiones podrían agravarse en un futuro próximo debido a sinergias o efectos indirectos relacionados con la globalización y los efectos del cambio climático (p. ej. Hulme 2017; aunque véase Lopez et al. 2022).
Las hormigas han sido catalogadas como uno de los taxones con mayor impacto invasor (p. ej. Siddiqui et al. 2021; Angulo et al. 2022), habiéndose detectado más de 200 especies introducidas fuera de su área original (Bertelsmeier et al. 2017), de las cuales 19 figuran como invasoras (Global Invasive Species Database 2024) y cinco entre las 100 especies con mayores impactos negativos para los ecosistemas en las que han sido introducidas (Lowe et al. 2000). El impacto de las hormigas invasoras radica en su carácter generalista, alta fecundidad y larga supervivencia debido a la poliginia (más de una reina por nido), facilidad de diseminación (autónoma o asistida), dominancia de recursos, capacidad de alteración de hábitats (revisado en Siddiqui et al. 2021) y de interacciones ecológicas a múltiples niveles (p. ej. Kamaru y col 2024). Sin embargo, la organización social particular de la mayoría de las hormigas invasoras es probablemente el rasgo principal que determina su gran éxito de colonización, formando una red de colonias compuesta por millones de individuos que se expanden sin competición intraespecífica (supercolonia) monopolizando los recursos frente a las especies nativas (p. ej. Helanterä et al. 2009, 2022). Se asume que, debido a fenómenos asociados a la pérdida de diversidad genética como el efecto fundador (colonización de un pequeño grupo no representativo de la variedad genética del rango nativo; Mayr 1954) y el cuello de botella (supervivencia y reproducción de sólo una parte de los colonizadores; p. ej. Nei et al. 1975), las hormigas introducidas invasoras se perciben como integrantes de una misma supercolonia, permitiendo a la supercolonia adquirir dimensiones que notoriamente multiplican las dimensiones que alcanzan en su rango nativo. Por ejemplo, la distribución de una supercolonia de la hormiga argentina (Linepithema humile) en su rango nativo (Brasil y Argentina) puede alcanzar algunos kilómetros (Heller 2004), mientras que, en el sur de Europa, donde se han introducido, la mayor supercolonia (principal) se expande por más de 6000 kilómetros (Giraud 2002). Es por lo tanto de importancia fundamental para la conservación desentrañar los mecanismos que subyacen a la unificación de las colonias de una supercolonia, pero también de aquéllos que podrían desfragmentarlas, incitando potencialmente a la competencia entre colonias y, por consiguiente, reduciendo su capacidad invasora (véase Sanmartín-Villar et al. 2022). Es por ello que, en este estudio, nos hemos enfocado en analizar las diferencias entre hormigas de localidades aisladas geográficamente que pudiesen deberse a la fragmentación de las supercolonias. Para ello, nos hemos centrado en una de las hormigas invasoras más extendidas a nivel global: la hormiga argentina.
A pesar de su introducción masiva y elevada dispersión, ciertos hallazgos parecen sugerir una reducción del potencial invasor de L. humile así como su posible colapso en ciertas zonas (Cooling et al. 2012) o la existencia de supercolonias competitivas en las áreas introducidas (donde la interacción entre hormigas conlleva una alta agresividad; Giraud et al. 2002; Tsutsui et al. 2003; Thomas et al. 2006; Hirata et al. 2008; Blight et al. 2010a; Mothapo y Wossler 2011; Berville et al. 2013). En Europa se han descrito tres supercolonias de la hormiga argentina. La supercolonia principal se distribuye desde el NO de España hasta Italia (Giraud 2002). La distribución de las otras dos supercolonias es menor, localizándose en ciertas zonas de la costa mediterránea y en sus islas (supercolonia catalana: Giraud et al. 2002; supercolonia corsa: Blight et al. 2010b, 2012). Las colonias de la supercolonia principal muestran alta variabilidad genética y tasa de agresión en la costa gallega (incluso superiores a las encontradas entre la supercolonia principal y la de Córcega; Sanmartín et al. 2022). Considerando que en Europa la diversidad genética y las supercolonias geográficamente más limitadas se han encontrado en ambientes próximos a sistemas insulares (en España, en las Islas Baleares y en las islas ubicadas en las Rías Baixas (Galiza); en Francia, en Córcega), nos hemos centrado en las posibles diferencias que la alopatría y las adaptaciones locales pudiesen ocasionar entre las poblaciones insulares y continentales de la supercolonia principal en Galiza (NO de España).
Teniendo en cuenta que la introducción de L. humile es relativamente reciente en la península ibérica (1890; Martins 1907), no esperábamos encontrar grandes diferencias en la morfología y el comportamiento de las obreras insulares respecto a las continentales, aunque sí esperábamos encontrar efectos generales de la insularidad. Por ejemplo, esperábamos un mayor tamaño en las hormigas de las islas dada la tendencia al gigantismo insular en especies de pequeño tamaño corporal (Foster 1964; Lomolino et al. 2012). Predijimos que los individuos de mayor movilidad podrían aumentar las probabilidades de acceder a las islas de forma activa, por ejemplo, a través de puentes artificiales o pasarelas producidas en mareas bajas; o pasiva, al ser transportados por otros animales (Holway 1995). Por tanto, esperábamos valores de locomoción más elevados en las obreras insulares que en las que habitan colonias continentales. La tigmotaxis, o navegación en función de la percepción mecánica del ambiente, constituye un método de navegación común en las hormigas (Dussutour et al. 2005) aunque también se ha interpretado como un síntoma de estrés o timidez en ciertas especies (Valle 1970; Walsh y Cummins 1976; Sneddon 2003; Carlson y Langkilde 2013; Detrain et al. 2019), o relacionado con procesos cognitivos como el aprendizaje (Sneddon 2003; Doria et al. 2019). Esperábamos que las hormigas insulares mostraran una menor tigmotaxis que las continentales, es decir, que dependieran menos de estímulos táctiles para orientarse. La reducción en el uso de referencias podría favorecer una mayor exploración de nuevos ambientes, especialmente de aquéllos con menor abundancia de materiales sobre el substrato como los costeros. Suponiendo la existencia de una única supercolonia en Galiza (Giraud et al. 2002; Sanmartín-Villar et al. 2022), esperábamos que las hormigas insulares y continentales sobreviviesen a enfrentamientos entre obreras de diferentes colonias a menos que éstas no se reconociesen como integrantes de la misma supercolonia, lo cual podría ser producto de fenómenos de divergencia entre ellas.
Material y métodos
Distribución y mantenimiento
Muestreamos un total de 19 localidades (11 insulares y 8 continentales; Tabla 1; Fig. 1) entre febrero y marzo de 2021 con el fin de localizar la presencia de L. humile. Se priorizó el muestreo de zonas cercanas a construcciones humanas debido a la antropofilia de esta especie (p. ej. Siddiqui et al. 2021; Angulo et al. 2022). El muestreo consistió en la búsqueda activa, excavando en la base de los árboles y levantando piedras, troncos de árboles, macetas, residuos y cubos de basura. Los nidos encontrados fueron extraídos. Se recogieron reinas, obreras, larvas y huevos utilizando herramientas de jardinería y cepillos y se transportaron y mantuvieron en recipientes de plástico (28 x 28 x 12 cm) con paredes barnizadas con Fluon®. Las hormigas fueron alimentadas semanalmente siguiendo la receta de Bhatkar y Whitcomb (1970), que consiste en una dieta con agar, huevo, miel, vitaminas y minerales. Para analizar las diferencias morfológicas y de comportamiento entre posibles colonias alopátricas, se recogieron seis colonias localizadas en tres poblaciones insulares (isla de Cortegada, isla de Arousa, isla de A Toxa) y tres poblaciones costeras continentales situadas cerca de las islas mencionadas (Trabanca, Vilanova de Arousa y A Lanzada; Tabla 1). Para analizar si las diferencias mostradas en las islas eran producto de una invasión relicta procedente del grupo genético sur (ver Sanmartín-Villar et al. 2022), también recolectamos colonias de hormigas localizadas en Pontevedra y Reboreda (Tabla 1). Las colonias se distanciaron en un mínimo de 1.43 km (Cortegada y Trabanca) y un máximo de 39.95 km (Reboreda y Cortegada).
Tabla 1. Localización de los muestreos realizados y de las poblaciones donde se recogieron los individuos experimentales. Altitud en metros. El grupo genético ha sido asumido en función de trabajos previos (Sanmartín-Villar et al. 2022), pero no genéticamente verificado. Las localizaciones se ordenan latitudinalmente. Las islas Cíes (Illa de Monteagudo e Illa do Faro) se representan por separado, aunque estén unidas por un puente y una playa. Presencia: detección y recolección de individuos de L. humile para su experimentación (Sí) o falta de detección de dicha especie (No) en las coordenadas proporcionadas, así como en sus alrededores o en toda la isla en el caso de las poblaciones insulares.
Table 1. Location of sampling sites and populations where experimental individuals were collected. Altitude in metres. The genetic group has been assumed based on previous studies (Sanmartín-Villar et al. 2022) but has not been genetically verified. Locations are ordered latitudinally. The Cíes Islands (Illa de Monteagudo and Illa do Faro) are represented separately even though they are connected by a bridge and a beach. Presence: detection and collection of L. humile individuals for experimentation (Sí) or lack of detection of this species (No) at the coordinates provided, as well as in the surrounding area or throughout the island in the case of island populations.
|
Localidad |
Presencia |
Acrónimo |
Tipo |
Grupo |
Ambiente |
Latitud |
Longitud |
Altitud |
|
Cortegada |
Sí |
COR |
Insular |
Norte |
Pinar |
42°36’59.7″ |
8°46’57.5″ |
6 |
|
Trabanca |
Sí |
TRA |
Continental |
Norte |
Agrícola |
42°36’56.5″ |
8°45’54.7″ |
38 |
|
Illa de Arousa |
Sí |
ARO |
Insular |
Norte |
Compost |
42°33’43.0″ |
8°52’35.8″ |
9 |
|
Vilanova de Arousa |
Sí |
VIL |
Continental |
Norte |
Parque urbano |
42°34’00.6″ |
8°49’42.6″ |
15 |
|
A Toxa |
Sí |
TOX |
Insular |
Norte |
Pinar |
42°29’11.8″ |
8°50’54.8″ |
10 |
|
O Facho |
No |
- |
Continental |
- |
Pinar, agrícola |
42°29'13.1" |
8°49'43.4" |
1 |
|
Sartaxes |
No |
- |
Continental |
- |
Agrícola |
42°28'40.1" |
8°49'35.3" |
1 |
|
O Couto de Abaixo |
No |
- |
Continental |
- |
Agrícola |
42°27'58.4" |
8°48'57.1" |
20 |
|
Sálvora |
No |
- |
Insular |
- |
Matorral |
42°28'14.4" |
9°00'15.5" |
5 |
|
A Lanzada |
Sí |
LAN |
Continental |
Norte |
Residuo plástico |
42°25’49.6″ |
8°52’22.2″ |
11 |
|
Pontevedra |
Sí |
PO |
Continental |
Sur |
Parque urbano |
42°26'23.7" |
8°38'14.5" |
10 |
|
Tambo |
No |
- |
Insular |
- |
Eucaliptal |
42°24'41.4" |
8°42'18.8" |
5 |
|
Ons |
No |
- |
Insular |
- |
Matorral |
42°22'34.7" |
8°55'58.3" |
20 |
|
Alvedosas (Norte) |
No |
- |
Insular |
- |
Matorral |
42°20'27.4" |
8°37'29.8" |
4 |
|
Alvedosas (Sur) |
No |
- |
Insular |
- |
Matorral |
42°20'22.9" |
8°37'23.4" |
4 |
|
San Simón |
No |
- |
Insular |
- |
Diverso |
42°18'27.0" |
8°37'42.6" |
29 |
|
Reboreda |
Sí |
RE |
Continental |
Sur |
Jardín |
42°17'14.1" |
8°35'21.7" |
101 |
|
Illa de Monteagudo |
No |
- |
Insular |
- |
Diverso |
42°13'37.3" |
8°53'56.3" |
6 |
|
Illa do Faro |
No |
- |
Insular |
- |
Diverso |
42°13'08.6" |
8°54'14.5" |
26 |
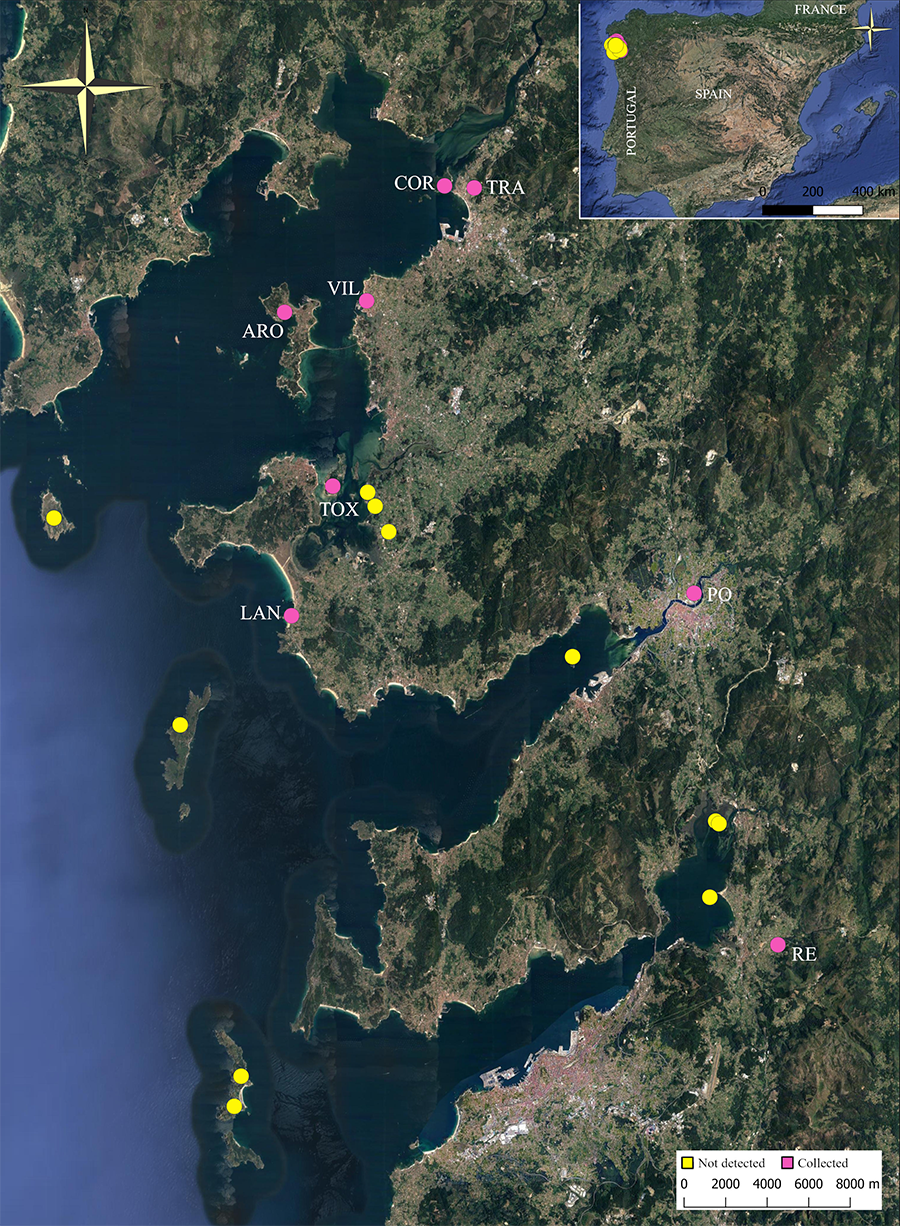
Figura 1. Distribución de Linepithema humile en Galiza. Amarillo: lugares donde no se encontró la especie (N= 11). Rosa: lugares donde se recolectó la especie (N= 8; con acrónimos). De norte a sur y de izquierda a derecha: Isla Cortegada, Trabanca, Vilanova de Arousa, isla de Arousa, isla de A Toxa, O Facho, Sartaxes, isla de Sálvora, O Couto de Abaixo, Pontevedra, A Lanzada, isla de Tambo, isla de Ons, islas Alvedosas (N= 2), isla de San Simón, Reboreda, islas de Monteagudo y Faro (Cíes).
Figure 1. Distribution of Linepithema humile in Galiza. Yellow: locations where the species was not found (N= 11). Pink: locations where the species was collected (N= 8; with acronyms). From north to south and from left to right: Cortegada Island, Trabanca, Vilanova de Arousa, Arousa Island, A Toxa Island, O Facho, Sartaxes, Sálvora Island, O Couto de Abaixo, Pontevedra, A Lanzada, Tambo Island, Ons Island, Alvedosas Islands (N= 2), San Simón Island, Reboreda, Monteagudo and Faro Islands (Cíes).
Morfometría
Se midió la distancia mínima entre los ojos de 25 obreras aleatoriamente seleccionadas y pertenecientes a cada una de las ocho colonias recogidas. Esta medida ha sido utilizada como estima indirecta del tamaño corporal (p. ej. Brassard 2018; Sanmartín-Villar y Jeanson 2021) y seleccionada por su correlación con el tipo de alimentación, la eficiencia en la localización de recursos y en la adaptación a la complejidad ambiental (Fowler et al. 1991; Gibb y Parr 2013; Ahuatzin et al. 2022), factores que, aunque no han sido analizados en este estudio, podrían diferir entre las localidades estudiadas según su condición insular o continental. Las mediciones se obtuvieron utilizando un objetivo binocular (Olympus SZ-ZTV) con cámara incorporada (Leica, FlexacamC1) y herramientas del programa Las X®.
Locomoción y tigmotaxis
Se seleccionaron al azar 50 hormigas obreras de cada colonia (independientemente de su tamaño y edad) y se colocaron individualmente en placas de Petri (Ø= 5.5 cm, altura= 1 cm) recubiertas de Fluon®. Las hormigas del grupo genético sur no se utilizaron en estas pruebas. Cada placa se cubrió con su propia tapa para evitar que las hormigas percibieran posibles perturbaciones externas. Las hormigas fueron registradas durante 10 minutos con una cámara de mano Canon Legria HF M56. Antes de realizar las pruebas, cada placa fue lavada con agua y secada con algodón para eliminar cualquier resto que hubiese podido quedar de las hormigas de la prueba anterior. Evitamos el uso de jabones con el fin de no alterar la percepción olfativa y el comportamiento de las hormigas. La permanencia potencial de compuestos apolares en las placas no debería influir en los resultados debido a la aleatorización del orden de las pruebas. Las pruebas se realizaron entre las 09:50 y las 13:20 h durante tres días en el mes de marzo. Debido a un problema con una de las grabaciones, una de las pruebas se repitió 33 días después. La trayectoria del movimiento realizado por cada individuo se extrajo mediante el programa SWISTRACK 4.0 (Correll et al. 2006) utilizando el método de Nearest Neighbour Tracking, una tasa de 2 fotogramas por segundo y considerando el desplazamiento cuando los individuos se movían más de un milímetro. Este programa permitió la extracción de las coordenadas por las que los individuos experimentales se desplazaron en el interior de las zonas experimentales. Se utilizó un código en R (R Core Team 2021) para transformar las coordenadas en las variables de estudio. La frecuencia de tiempo en movimiento transcurrido en los 10 minutos de la prueba se seleccionó como variable de estudio (locomoción) en lugar de la distancia total recorrida para homogeneizar posibles diferencias ligadas al tamaño y la velocidad de los individuos experimentales. El uso de arenas vacías (open field) garantizó la homogeneidad y estandarización del ambiente en el que medir el comportamiento locomotor de los individuos. Calculamos el tiempo que las hormigas estuvieron cerca del borde de la placa (5 mm) en las pruebas de 10 minutos como un indicador de la tigmotaxis.
Competencia intraespecífica
Se seleccionaron al azar 50 hormigas obreras por colonia de las ocho colonias recolectadas y se enfrentaron por parejas en placas de Petri (Ø= 5.5 cm, altura= 1 cm) recubiertas de Fluon®. Los enfrentamientos se realizaron alternando el orden de adición de cada individuo para evitar el efecto residente (Shreeve 1987; Peixoto y Benson 2012, pero véase Kemp y Wiklund 2004). Cada placa se cubrió con su tapa tras la adición de la segunda hormiga. Las pruebas se realizaron a las 10:00 h durante seis días consecutivos. Las placas se lavaron con agua y se secaron con algodón antes de cada prueba (véase arriba la explicación sobre el uso de jabones y disolventes apolares). Se colocó algodón húmedo en cada placa para mantener la humedad. Al cabo de 24h, registramos el número de individuos muertos por placa (cero, uno o dos; siguiendo a Blight et al. 2010b) como indicador indirecto de la intensidad de la competencia intraespecífica. Los individuos enfrentados no fueron marcados con el fin de no interferir en su percepción olfativa, lo cual produjo la imposibilidad de su identificación, y, por lo tanto, de la identificación de su origen al finalizar la prueba. Por lo tanto, el análisis de mortalidad se efectuó considerando la proporción de individuos muertos entre el total de individuos enfrentados en cada combinación. Comparamos la mortalidad de hormigas obreras enfrentando por pares todas las posibles combinaciones de localidades considerando las colonias insulares (véase el significado de los acrónimos en la Tabla 1): (i) colonias insulares enfrentadas entre sí (COR-ARO, COR-TOX, ARO-TOX), (ii) colonias insulares enfrentadas con la colonia continental más cercana perteneciente al asumido grupo genético del norte (COR-TRA, ARO-VIL, TOX-LAN), (iii) colonias insulares y colonias continentales distanciadas pertenecientes al asumido grupo genético del norte (COR-VIL, COR-LAN, ARO-TRA, ARO-LAN, TOX-TRA, TOX-VIL), (iv) colonias insulares y colonias continentales distanciadas pertenecientes al asumido grupo genético del sur (COR-PO, COR-RE, ARO-PO, ARO-RE, TOX-PO, TOX-RE), y (v) hormigas de la misma colonia (control; COR-COR, ARO-ARO, TOX-TOX, TRA-TRA, VIL-VIL, LAN-LAN). No se realizaron pruebas del grupo control para las hormigas de las colonias del asumido grupo genético sur.
Durante las pruebas de comportamiento los/as observadores/as se mantuvieron alejados de las hormigas y usaron máscaras y guantes cuando manipulaban a los individuos para evitar la exhalación y la transferencia de los olores de las manos (véase Chen y Nonacs 2006).
Análisis estadístico
Los datos se analizaron utilizando el software estadístico R versión 4.1.0 (R Core Team 2021). Las variables cumplieron los supuestos necesarios para realizar análisis paramétricos. Se utilizaron pruebas ANOVA para comparar las siguientes variables: tamaño (distancia mínima entre ojos), locomoción (proporción de tiempo en movimiento sobre los 10 min de observación), tigmotaxis (proporción de tiempo en los 5 mm del borde de la placa de Petri, dónde las hormigas podían establecer contacto físico con los muros de la placa) y mortalidad tras el enfrentamiento de hormigas obreras de las localidades muestreadas. Los valores de estas variables se compararon entre las colonias muestreadas salvo para la mortalidad, la cual fue comparada entre el tipo combinaciones efectuadas en los enfrentamientos (isla-isla, isla-continente próximo, isla-continente distanciado, isla-grupo genético sur, control). Se optó por la categorización de este factor en lugar de usar la distancia real entre las colonias con el fin de homogeneizar el efecto de la distancia con el bajo número muestral resultante (ver resultados) y debido a la subjetividad ligada a la elección de la distancia entre colonias (línea recta, mínima distancia sobre sustrato terrestre, mínima distancia sobre ambientes antrópicos, etc). Se aplicaron pruebas post hoc (emmeans, v. 1.11.2; Lenth 2025) para discernir las diferencias entre las colonias y de cada uno de los tipos de combinaciones (Tabla A1 del Anexo).
Resultados
Distribución
Encontramos L. humile en ocho de las 19 localidades estudiadas (Tabla 1; Fig. 1). La distribución insular de esta especie se restringió a las islas conectadas al continente por puentes humanos (Isla de Arousa y de A Toxa) o naturales, como es el caso de la isla de Cortegada, que conecta al continente cuando las mareas son muy bajas. No se encontraron colonias de L. humile en las islas de Sálvora, Tambo, Ons, Cíes (islas Monteagudo y Faro), Alvedosas (N= 2) y San Simón (islas sin conexión terrestre con la costa continental), ni en las zonas continentales del ayuntamiento de Cambados (O Facho, Sartaxes y O Couto de Abaixo). En los lugares en los que fue encontrada, L. humile ocupaba ambientes heterogéneos (Tabla 1).
Morfometría
Las hormigas de las diferentes colonias analizadas mostraron una distancia interocular diferente (F7;192= 11.01, p< 0.001). Las hormigas insulares mostraron una mayor distancia interocular que las continentales más próximas (grupo genético norte; Isla de Arousa - Vilanova: t= 4.62, p<0.001; isla de A Toxa - A Lanzada: t= 4.16, p= 0.001; Fig. 2) salvo las hormigas de la isla de Cortegada, que mostraron valores semejantes a los medidos en las hormigas de Trabanca (t= -1.16, p= 0.943). Las obreras de las islas de Arousa y A Toxa mostraron una distancia interocular similar (t= -0.46, p= 1), pero mayor que la de las hormigas de la isla de Cortegada (isla de Arousa - isla de Cortegada: t= 6.47, p< 0.001; isla de A Toxa - isla de Cortegada: t= 6.01, p< 0.001). Las hormigas continentales del grupo genético norte mostraron una menor distancia interocular que las hormigas continentales del grupo sur (t= 30.70, p< 0.001), mientras que las hormigas de dos de las tres colonias insulares mostraron valores similares a los de las hormigas del grupo genético sur (Fig. 2; Tabla A1 del Anexo; véanse las diferencias del tamaño entre las hormigas del grupo sur y las de la isla de Cortegada). Las hormigas de las colonias continentales del grupo genético norte mostraron la misma mediana.
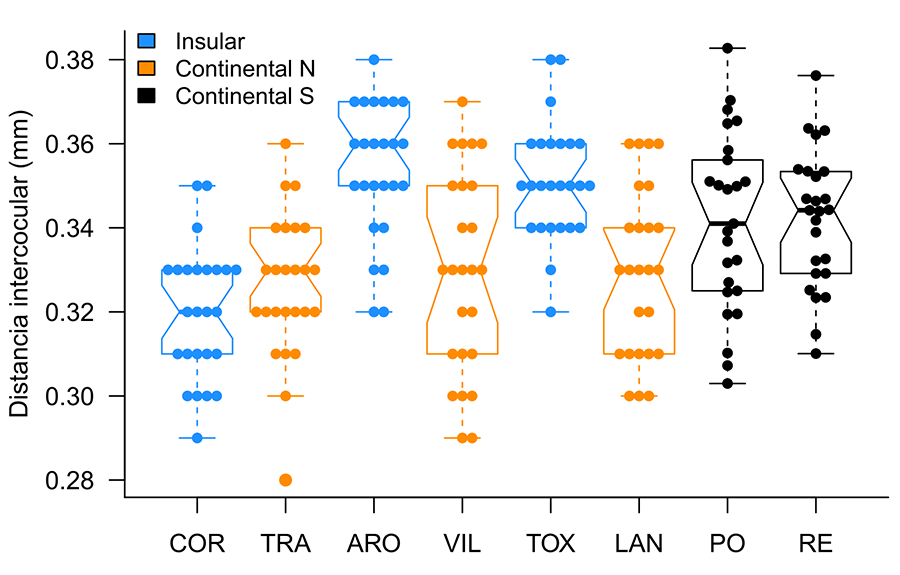
Figura 2. Distancia mínima entre los ojos (mm) de las obreras pertenecientes a las ocho colonias estudiadas. La línea horizontal gruesa de cada recuadro representa la mediana y las líneas horizontales finas inferior y superior indican los cuartiles primero y tercero. Las líneas conectan por líneas de puntos hasta los valores más extremos dentro de 1.5 rangos intercuartílicos desde el primer y tercer cuartil, respectivamente. Las localidades aparecen ordenadas siguiendo el eje longitudinal norte-sur y agrupando las colonias insulares con sus vecinas continentales. COR: Isla de Cortegada, TRA: Trabanca, ARO: Isla de Arousa, VIL: Vilanova de Arousa, TOX: Isla de A Toxa, LAN: A Lanzada. Continental N: colonias continentales en las cuales se asume que pertenecen al grupo genético norte. Continental S: colonias continentales en las cuales se asume que pertenecen al grupo genético sur (véase Sanmartín-Villar et al. 2022).
Figure 2. Minimum distance between the eyes (mm) of workers belonging to the eight colonies studied. The thick horizontal line in each box represents the median, and the thin horizontal lines above and below indicate the first and third quartiles. The lines connect the most extreme values within 1.5 interquartile ranges from the first and third quartiles, respectively. The locations are ordered along the north-south longitudinal axis, grouping island colonies with their mainland neighbours. COR: Cortegada Island, TRA: Trabanca, ARO: Arousa Island, VIL: Vilanova de Arousa, TOX: A Toxa Island, LAN: A Lanzada. Continental N: mainland colonies assumed to belong to the northern genetic group. Continental S: mainland colonies assumed to belong to the southern genetic group (see Sanmartín-Villar et al. 2022).
Locomoción y tigmotaxis
Las hormigas de las diferentes colonias analizadas mostraron una locomoción diferente (F5;282= 5.76, p< 0.001). Las diferencias entre la locomoción de las hormigas obreras que habitaban colonias insulares y las del continente más cercano tampoco siguieron un patrón común. Las obreras de las islas de Cortegada y A Toxa se movieron de forma similar a las de Trabanca (t= 0.32, p= 0.995) y Lanzada (t= 2.59, p= 0.104), respectivamente (Fig. 3A). Las de la isla de Arousa mostraron menor movimiento que las de Vilanova (t= -4.01, p= 0.001) y que las de A Toxa (t= -4.34, p< 0.001). Las hormigas de A Toxa se movieron más que las de Trabanca (localidad continental distanciada; t= 3.21, p= 0.018).
Las hormigas de las diferentes colonias analizadas mostraron una tigmotaxis diferente (F5;282= 2.80, p= 0.017; Fig. 3B). Aunque todas las hormigas obreras insulares mostraron una tendencia hacia una menor tigmotaxis que las hormigas obreras que habitaban las colonias continentales más cercanas, no se observaron diferencias significativas entre ellas. Las obreras de las distintas islas mostraron una tigmotaxis similar (Tabla A1 del Anexo). Las hormigas de la isla de Arousa mostraron una menor tigmotaxis que las hormigas de Trabanca (t= -3.17, p= 0.021) y A Lanzada (t= -2.89, p= 0.047).
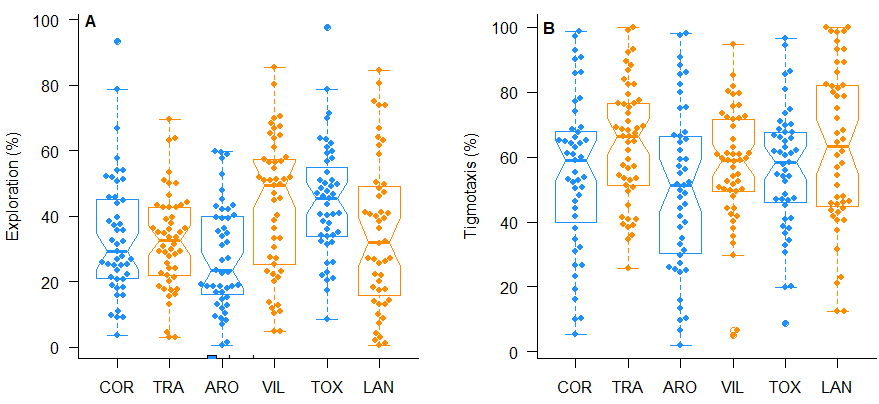
Figura 3. Proporción de tiempo en que las obreras estuvieron en movimiento (A) y cerca del borde de la placa (tigmotaxis; B). La línea horizontal gruesa de cada recuadro representa la mediana y las líneas horizontales finas inferior y superior indican los cuartiles primero y tercero. Las líneas conectan por líneas de puntos hasta los valores más extremos dentro de 1.5 rangos intercuartílicos desde el primer y tercer cuartil, respectivamente. Las localidades aparecen ordenadas siguiendo el eje longitudinal norte-sur y agrupando las colonias insulares con sus vecinas continentales. COR: Isla de Cortegada, TRA: Trabanca, ARO: Isla de Arousa, VIL: Vilanova de Arousa, TOX: Isla de A Toxa, LAN: A Lanzada.
Figure 3. Proportion of time spent by workers in motion (A) and near the edge of the plate (thigmotaxis; B). The thick horizontal line in each box represents the median, and the thin horizontal lines above and below indicate the first and third quartiles. The lines connect the most extreme values within 1.5 interquartile ranges from the first and third quartiles, respectively, with dotted lines. The locations are ordered along the north-south longitudinal axis, grouping the island colonies with their mainland neighbours. COR: Cortegada Island, TRA: Trabanca, ARO: Arousa Island, VIL: Vilanova de Arousa, TOX: A Toxa Island, LAN: A Lanzada.
Mortalidad
La mortalidad de las hormigas difirió en función del tipo de combinación efectuada (F5;21= 4.48, p= 0.006). La mayor mortalidad se observó en las pruebas donde se enfrentaron obreras insulares con sus vecinas continentales más próximas (isla de Cortegada – Trabanca; isla de Arousa – Vilanova; isla de A Toxa - A Lanzada; donde el 34.67 % de placas contenía al menos una hormiga muerta; Fig. 4). La mortalidad de estos enfrentamientos superó a la encontrada en el resto de enfrentamientos (entre controles: t= 3.87, p= 0.010; entre colonias continentales del grupo genético norte: t= 3.28, p= 0.037; entre colonias insulares y colonias continentales distanciadas del grupo genético norte: t= 4.14, p= 0.006; entre colonias insulares: t= 3.73, p= 0.014) excepto a la mortalidad encontrada en los enfrentamientos entre las obreras insulares y las del asumido grupo genético sur (t= 2.66, p= 0.125). La mayor mortalidad se registró en las parejas de la isla de Arousa y Vilanova (el 64 % de las placas contenían hormigas muertas), mientras que la mortalidad fue baja en las placas de la pareja isla de A Toxa – A Lanzada (8 %). Las demás combinaciones no mostraron diferencias respecto a la mortalidad obtenida en los grupos de control (Tabla A1 del Anexo).
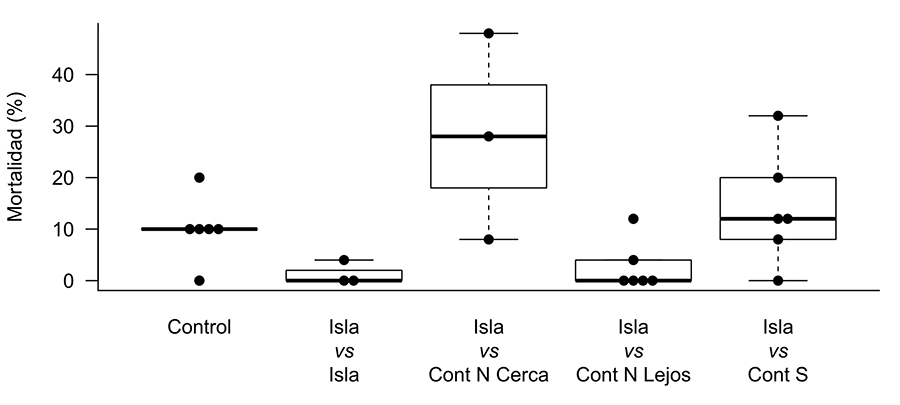
Figura 4. Porcentaje de placas con obreras muertas tras 24h de su enfrentamiento. Control: hormigas de la misma colonia (COR-COR, ARO-ARO, TOX-TOX, TRA-TRA, VIL-VIL, LAN-LAN); Isla vs Isla: colonias insulares enfrentadas entre sí (COR-ARO, COR-TOX, ARO-TOX); Isla vs Cont N Cerca: colonias insulares enfrentadas con la colonia continental más cercana perteneciente al asumido grupo genético del norte (COR-TRA, ARO-VIL, TOX-LAN); Isla vs Cont S: colonias insulares y colonias continentales distanciadas pertenecientes al asumido grupo genético del sur (COR-PO, COR-RE, ARO-PO, ARO-RE, TOX-PO, TOX-RE).
Figure 4. Percentage of plates with dead workers 24 hours after confrontation. Control: ants from the same colony (COR-COR, ARO-ARO, TOX-TOX, TRA-TRA, VIL-VIL, LAN-LAN); Island vs Island: island colonies confronted with each other (COR-ARO, COR-TOX, ARO-TOX); Island vs Cont N Cerca: island colonies facing the nearest mainland colony belonging to the assumed northern genetic group (COR-TRA, ARO-VIL, TOX-LAN); Island vs Cont S: island colonies and distant mainland colonies belonging to the assumed southern genetic group (COR-PO, COR-RE, ARO-PO, ARO-RE, TOX-PO, TOX-RE).
Discusión
A pesar de la cercanía de las islas gallegas al continente y de la distribución costera de Linepithema humile, sólo detectamos su presencia en islas temporal o continuamente conectadas con el continente. La mayor tasa de mortalidad se registró en enfrentamientos entre obreras de colonias insulares con las continentales más cercanas, las cuales mostraron ciertas diferencias de tamaño (distancia entre ojos) y semejante comportamiento. No se encontraron diferencias entre la mortalidad de esta combinación de colonias y la observada entre las hormigas insulares y las del grupo genético sur, estando las segundas más distanciadas de las islas que las del grupo norte (con las que no mostraron agresividad cuando las colonias no eran vecinas) y a pesar de la semejanza de tamaño entre estas hormigas (salvo las de la isla de Cortegada). El reducido número de comparaciones entre colonias consecuente de la escasa detección de L. humile en las islas muestreadas limita la extrapolación de nuestros resultados. No obstante, consideramos que estos resaltan fenómenos relevantes para la interpretación de la organización y evolución de las supercolonias y sugieren posibles medidas para el control de L. humile y la conservación de los ecosistemas en los que ha sido introducida.
Nuestras observaciones sugieren que el mar constituye una barrera limitante para la colonización activa por parte de L. humile. El éxito de colonización de islas remotas es frecuentemente realizado por especies con fuerte capacidad de dispersión, mientras que la colonización de islas cercanas al continente depende más de la capacidad competitiva en especies con débil capacidad de dispersión (Zhao et al. 2020). En general, las hormigas colonizan islas mediante vuelos nupciales, formando balsas con sus cuerpos o sobre objetos flotantes o siendo asistidas por otras especies (Holway 1995; Azuma et al. 2006; Mlot et al. 2011). Las hembras de L. humile no realizan vuelos nupciales puesto que son fecundadas en el interior de los nidos donde nacen y su dispersión se realiza por el flujo terrestre de propágulos (Hee et al. 2000). Aunque tanto reinas como obreras pueden aventurarse a desplazarse por el agua utilizando la tensión superficial de ésta (al menos en condiciones de laboratorio; I. Sanmartín Villar, observación personal), no hemos encontrado citas bibliográficas que apoyen la dispersión de L. humile en balsas creadas con sus cuerpos. Por lo tanto, el transporte sobre materiales a la deriva o la dispersión asistida parecen ser las alternativas más utilizadas por esta especie para sobrepasar masas acuáticas (Suarez et al. 2001; Castro-Cobo et al. 2019). Cortegada ha desempeñado un papel estratégico en el trabajo y ocio de los habitantes de sus alrededores a lo largo de las últimas décadas y, con menor frecuencia, también ha sido frecuentada por mamíferos salvajes procedentes del continente (de la Peña-Lastra 2009; Velo-Antón et al. 2025), lo que teóricamente permitiría un flujo asistido de hormigas hacia la isla. Sin embargo, el escenario presente en el resto de las islas parece contradecir dicha hipótesis. Por ejemplo, el Parque Nacional de las Islas Atlánticas (islas de Sálvora, Cortegada, Cíes y Ons) es un lugar turístico frecuentemente visitado (casi medio millón de personas al año; Organismo Autónomo Parques Nacionales 2022) del que sólo hemos detectado L. humile en Cortegada. La dispersión asistida de L. humile podría limitarse al transporte naval de recursos como tierra o plantas en los que se podrían incluir nidos o un número considerable de hormigas. Sin embargo, no podemos descartar que la colonización de Cortegada por parte de la hormiga argentina se haya producido de forma activa mediante propágulos. Aunque en raras ocasiones, las mareas más bajas permiten el acceso por tierra hasta la isla. Por lo tanto, podría esperarse que islas de semejante condición como las Alvedosas e incluso San Simón reciban una futura colonización, lo cual podría suponer un gran impacto ecológico debido a la alta diversidad mirmecológica de las primeras (I. Sanmartín Villar; observación personal), y porque no existen planes de conservación para las comunidades entomológicas de estas islas. Por lo tanto, recomendamos una vigilancia especial de la introducción de L. humile en las islas gallegas, especialmente en aquéllas próximas a la costa, pero también en lo relacionado con el transporte de recursos a aquéllas que forman parte del Parque Nacional de las Islas Atlánticas. Cabe destacar que el éxito de colonización de una especie no solo reside en su capacidad de dispersión sino también en su adaptación a nuevos medios. Aunque las condiciones del sur europeo parecen ser óptimas para la supervivencia de L. humile, factores bióticos (p. ej. Blight et al. 2010a; aunque véase Castro-Cobo et al. 2019) o abióticos (p. ej. Menke et al. 2007) locales podrían oponerse a su establecimiento. El efecto de factores limitantes podría verse atenuado en un futuro próximo a causa de las consecuencias del cambio climático, fomentando la colonización de L. humile en ambientes en los que en la actualidad no ha sido detectada.
El conocimiento de las diferencias de tamaño corporal entre islas y continente en insectos es aún fragmentario (ver Palmer 2002), particularmente en hormigas (Zhao et al. 2020). El gigantismo esperado en islas no ha sido observado, siendo únicamente respaldada una tendencia hacia un mayor tamaño de las hormigas en dos de las tres comparaciones hechas entre poblaciones insulares y sus vecinas continentales. Sin embargo, otros estudios (p. ej. Heaneyl 1978; Palmer 2002) señalan que este fenómeno depende de factores geográficos como los propuestos en la Teoría de Biogeografía Insular (área de la isla y distancia al continente; MacArthur y Wilson 1967). Las menores distancias interoculares se encontraron en las obreras que habitan en la isla de Cortegada, que tiene la menor superficie (0.58 km²), mientras que las mayores distancias interoculares se encontraron en Arousa (6.91 km²) y Toxa (1.17 km²). Las especies de hormigas que muestran ojos más separados descubren, ocupan y acaparan más recursos alimenticios, además de mostrar una mejor adaptación en entornos complejos (Gibb y Parr 2013; Ahuatzin et al. 2022; pero véase Yates et al. 2014), los cuales podrían aumentar en función de la superficie de la isla. Futuros estudios podrían dilucidar si este fenómeno puede extrapolarse a la variabilidad intraespecífica. Sin embargo, no podemos descartar que las diferencias morfométricas sean fruto de la diferencia temporal en la cual la colonización de la isla se hubiera producido, a la inversión de recursos que las colonias inviertan en las primeras fases de colonización o a la diferente dieta asequible en cada una de las zonas (Abril et al. 2013).
Las hormigas insulares mostraron diferencias heterogéneas respecto a la distancia interocular pero un comportamiento semejante al de sus vecinas continentales. Las de la isla de Cortegada fueron las que más se asemejaron a sus vecinas continentales (Trabanca) en lo que respecta a tamaño y comportamiento. Las obreras de la isla de A Toxa solo difirieron en tamaño respecto a las de A Lanzada. Las hormigas de la isla de Arousa mostraron un mayor tamaño y una menor locomoción respecto a las de Vilanova. A pesar de que con este trabajo no podremos descifrar si los resultados observados son un reflejo de las características que mostraban las hormigas pioneras de la colonización de las islas o si estos son producto de la adaptación local a las islas (por ejemplo, superficie, recursos, presiones ambientales), podemos sugerir que existen diferencias entre poblaciones insulares y continentales responsables de la diferente mortalidad, especialmente al enfrentar colonias insulares con sus vecinas continentales (aunque la combinación entre A Toxa y A Lanzada no cumple la misma tendencia). La mortalidad detectada ha sido menor que la esperada tras enfrentar hormigas de diferentes supercolonias (en torno al 98 % de ataques; Giraud 2002) y semejante a la encontrada entre los grupos genéticos gallegos de la supercolonia principal (menos de 50 % de ataques; Sanmartín-Villar et al. 2022).
Nuestros resultados podrían interpretarse en base a la competencia entre colonias que hayan sufrido evolución divergente en condiciones de alopatría. La influencia de factores locales y la limitación del flujo de individuos entre colonias debido a las barreras geológicas (mar) podrían haber condicionado las diferencias morfológicas y de comportamiento entre las colonias insulares y continentales. El aislamiento modifica la composición química de la cutícula de las hormigas (Pontin 1961), la cual representa el sistema de reconocimiento entre hormigas y desencadena la agresividad contra hormigas ajenas a la colonia. La composición química de la cutícula podría modificarse con el aislamiento insular debido a cambios en la dieta (Liang y Silverman 2000; Buczkowski et al. 2005; pero véase Giraud et al. 2002), y a la variabilidad genética (Thomas et al. 2006). Estudios futuros que analicen la variabilidad genética y los hidrocarburos cuticulares de estas poblaciones podrían discernir si el nivel de divergencia entre las poblaciones es debido a la alopatría. La heterogeneidad de los factores locales podría explicar la falta de un patrón común de divergencia entre las colonias insulares y continentales, aunque un mayor tamaño muestral sería necesario para confirmarlo
De producirse únicamente una diferenciación alopátrica, las hormigas insulares diferirían y competirían contra el resto de las hormigas de colonias continentales. Sin embargo, los resultados apuntan a que la competencia de las hormigas insulares se limita hacia las colonias continentales vecinas. El fenómeno evolutivo que incrementa la competición entre poblaciones vecinas más que entre poblaciones alejadas ha sido catalogado como el efecto de las “vecinas molestas” (nasty neighbours; Muller y Manser 2007). Este efecto podría explicar el antagonismo entre colonias colindantes que, tras sufrir divergencia evolutiva, no se reconocen como miembros de una misma supercolonia; a la vez que muestran una falta de respuesta agresiva ante individuos de colonia alejadas, con las que la frecuencia de encuentro debe ser muy reducida o inexistente. Los ataques entre vecinos y la falta de agonismo hacia rivales no conectados constituyen un patrón conocido de L. humile en California (Thomas et al. 2006, 2007) así como en otras especies de hormigas (p. ej. Oecophylla smaragdina: Newey et al. 2010; Liometopum microcephalum: Keresztes et al. 2020) que podría depender más de barreras geográficas que de la distancia entre colonias (Heller 2004). Este fenómeno refuerza la territorialidad de las especies y garantiza la lucha por la obtención de recursos con su competidor más frecuente (el más cercano; Newey et al. 2010), en oposición al efecto de la “querida enemiga” (dear enemy) donde la agresividad de los organismos vecinos se reduce como mecanismo evolutivo que reduce costes ante continuos enfrentamientos (Wilson 1975) y que también se observa en L. humile (p. ej. Trigos-Peral et al. 2021). El efecto de las “vecinas molestas” entre las colonias insulares y continentales de L. humile podría mantener su aislamiento y favorecer una evolución divergente. Sin embargo, la agresividad entre A Toxa y A Lanzada no siguió el patrón observado en las otras dos parejas que enfrentaban colonias insulares y continentales cercanas. Elegimos incluir hormigas de la colonia de A Lanzada al no haber encontrado L. humile en la costa más cercana de la isla de A Toxa (Tabla 1; Fig. 1) y decidimos no seleccionar colonias de O Grove (istmo frente a la isla) porque consideramos que las posibles colonias que allí habitaban podrían ser muy similares a las de la isla debido a su proximidad, a la presencia de un puente y a su relación con el continente. Por lo tanto, la falta de agresividad entre las hormigas de A Toxa y A Lanzada podría explicarse por el hecho de que A Lanzada puede que no sea la colonia continental más cercana a la isla de A Toxa y, por tanto, que las hormigas de ambas colonias actuasen como colonias distanciadas del mismo grupo genético.
La ausencia de mortalidad entre obreras insulares y continentales distanciadas del grupo genético norte descarta la existencia de un nuevo grupo genético insular, aunque dicha aseveración requiera análisis más exhaustivos. El agonismo entre las obreras insulares con las del grupo genético sur parece seguir la misma tendencia que la observada entre los dos grupos genéticos gallegos (Sanmartín-Villar et al. 2022), sugiriendo que las colonias insulares pertenecían originalmente al grupo septentrional más que al meridional, aunque las hormigas insulares mostraron un tamaño más semejante al del grupo genético sur que a las del grupo genético norte.
En este trabajo consideramos que la colonización de las islas se produjo posteriormente a la colonización del continente debido a la mayor intensidad de flujo naval de los puertos continentales, asumiendo el medio marítimo como explicativo de la introducción de la hormiga argentina. Sin embargo, los primeros registros que se tienen de la introducción de L. humile en Europa son de la isla de Madeira (Wetterer y Wetterer 2006). Por lo tanto, la interpretación de nuestros resultados podría revertirse si la introducción de estas hormigas se hubiera producido en las islas gallegas y desde allí colonizasen el continente. La radiación de una especie aumenta en las islas y de ellas, los individuos poseen ventajas de expansión entre islas y zonas continentales (Lapiedra et al. 2021). Futuros estudios deberían desentrañar la historia de la colonización de esta especie para descifrar el escenario metapoblacional actual.
En resumen, la novedad de nuestro estudio reside en la identificación de L. humile en las islas del sur de Galiza y la agresión intraespecífica de estas colonias frente a las colonias continentales más cercanas, lo que podría constituir un factor que incrementase la competencia dentro de la supercolonia. De ser el caso, este fenómeno formaría parte de otro de los fenómenos de divergencia evolutiva observado en las islas de las Rías Baixas, como se ha demostrado con el cambio de actividad y reproducción de las salamandras (Salamandra salamandra; Velo-Antón et al. 2015; Velo-Antón y Cordero-Rivera 2017) y el cambio de dieta (a presas marinas) de la culebra Natrix maura (Galán 2012; Fuentes y Escoriza 2015). Desafortunadamente para la conclusión de este trabajo – aunque afortunadamente para la conservación de las islas -, el tamaño de nuestra muestra se vio limitado por la no detección de L. humile en las islas gallegas, lo cual dificulta la elaboración de extrapolaciones sobre el efecto alopátrico en esta especie. Futuros estudios deberían llevarse a cabo en áreas que muestren rasgos geográficos que favorezcan el aislamiento de las colonias para desentrañar si la evolución divergente está modificando las supercolonias de L. humile. El estudio de las poblaciones insulares y las continentales más cercanas podrá ayudarnos a comprender los fenómenos involucrados en la rápida colonización y potencial divergencia de las especies invasoras.
Contribuciones de los autores
BMFC: Curación de datos, Análisis formal, Investigación, Metodología, Software, Redacción - borrador original, Redacción - revisión y edición. ACR: Recursos, Validación, Redacción - revisión y edición. ISV: Conceptualización, Curación de datos, Análisis formal, Investigación, Metodología, Recursos, Software, Supervisión, Redacción - borrador original, Redacción - revisión y edición.
Disponibilidad de datos
Los datos utilizados en este trabajo se encuentran disponibles en https://doi.org/10.5281/zenodo.16572402
Financiación, permisos requeridos, potenciales conflictos de interés y agradecimientos
Este trabajo cumplió la legislación vigente en España sobre el uso de invertebrados en investigación.
Los autores declaran que no tienen intereses económicos en conflicto ni relaciones personales que pudieran haber influido en el trabajo presentado en este artículo.
Agradecemos a los/as tres revisores/as que han contribuido a mejorar la calidad de este trabajo. A la Xunta de Galicia, al personal del Parque Nacional das Illas Atlánticas y de la isla de San Simón, y a la Escola Naval Militar de Marín por permitir el acceso a las islas visitadas. A María Dolores Rodríguez Poza por la ayuda en la localización de las hormigas. A Raphaël Jeanson y Violette Chiara por la elaboración del código para la extracción de trayectorias.
Referencias
Abril, S., Diaz, M., Enriquez, M.L., Gomez, C. 2013. More and bigger queens: a clue to the invasive success of the Argentine ant (Hymenoptera: Formicidae) in natural habitats. Myrmecological News 18, 19-24.
Adla, K., Dejan, K., Neira, D., Dragana, Š. 2022. Degradation of ecosystems and loss of ecosystem services. One Health: Integrated Approach to 21st Century Challenges to Health 281–327. https://doi.org/10.1016/B978-0-12-822794-7.00008-3
Ahmed, D.A., Haubrock, P.J., Cuthbert, R.N., Bang, A., Soto, I., Balzani, P., Tarkan, A.S., et al. 2023. Recent advances in availability and synthesis of the economic costs of biological invasions. BioScience, 73(8), 560–574. https://doi.org/10.1093/biosci/biad060
Ahuatzin, D.A., González-Tokman, D., Silva, R.R., González, J.E.V., Escobar, F., Ribeiro, M.C., López Acosta, J.C., et al. 2022. Forest cover modulates diversity and morphological traits of ants in highly fragmented tropical forest landscapes. Biodiversity and Conservation 31(8), 2097-2117. https://doi.org/10.1007/s10531-022-02428-3
Angulo, E., Hoffmann, B.D., Ballesteros-Mejia, L., Taheri, A., Balzani, P., Bang, A., Renault, D., et al. 2022. Economic costs of invasive alien ants worldwide. Biological Invasions 24(7), 2041-2060. https://doi.org/10.1007/s10530-022-02791-w
Azuma, N., Ogata, K., Kikuchi, T., Higashi, S. 2006. Phylogeography of Asian weaver ants, Oecophylla smaragdina. Ecological Research 21, 126–136. https://doi.org/10.1007/s11284-005-0101-6
Bertelsmeier, C., Ollier, S., Liebhold, A., Keller, L. 2017. Recent human history governs global ant invasion dynamics. Nature Ecology and Evolution 1, 0184 . https://doi.org/10.1038/s41559-017-0184
Berville, L., Blight, O., Renucci, M., Hefetz, A., Provost, E. 2013. A peaceful zone bordering two Argentine ant (Linepithema humile) supercolonies. Chemoecology 23, 213–218. https://doi.org/10.1007/s00049-013-0135-0
Bhatkar, A., Whitcomb, W.H. 1970. Artificial diet for rearing various species of ants. Florida Entomologist 53, 229–232. https://doi.org/10.2307/3493193
Blight, O., Provost, E., Renucci, M., Tirard, A., Orgeas, J. 2010a. A native ant armed to limit the spread of the Argentine ant. Biological Invasions 12(11), 3785–3793. https://doi.org/10.1007/s10530-010-9770-3
Blight, O., Renucci, M., Tirard, A., Orgeas, J., Provost, E. 2010b. A new colony structure of the invasive Argentine ant (Linepithema humile) in Southern Europe. Biological Invasions 12, 1491–1497 https://doi.org/10.1007/s10530-009-9561-x
Blight, O., Berville, L., Vogel, V., Hefetz, A., Renucci, M., Orgeas, J., Provost, E., et al. 2012. Variation in the level of aggression, chemical and genetic distance among three supercolonies of the Argentine ant in Europe. Molecular Ecology 21, 4106–4121.
Brassard, F. 2018. Temperature drives caste-specific size and shape clines in North American ants. Tesis doctoral. Concordia University.
Buczkowski, G., Kumar, R., Suib, S.L., Silverman J. 2005. Diet-related modification of cuticular hydrocarbon profiles of the argentine ant, Linepithema humile, diminishes intercolony aggression. Journal of Chemical Ecology 31, 829–843. https://doi.org/10.1007/s10886-005-3547-7
Carlson, B.E., Langkilde, T. 2013. Personality traits are expressed in Bullfrog tadpoles during open-field trials. Journal of Herpetology 47, 378–383. https://doi.org/10.1670/12-061
Castro-Cobo, S., Carpintero, S., Reyes-López, J.L., Sergio, F., Angulo, E. 2019. Humans and scavenging raptors facilitate Argentine ant invasion in Doñana National Park: no counter-effect of biotic resistance. Biological Invasions 21(6), 2221–2232. https://doi.org/10.1007/s10530-019-01971-5
Chen, J.S.C, Nonacs, P. 2006. Nestmate recognition and intraspecific aggression based on environmental cues in Argentine ants (Hymenoptera: Formicidae). Annals of the Entomological Society of America 93, 1333–1337. https://doi.org/10.1603/0013-8746(2000)093[1333:nraiab]2.0.co;2
Cooling, M., Hartley, S., Sim, D.A., Lester, P.J. 2012. The widespread collapse of an invasive species: Argentine ants (Linepithema humile) in New Zealand. Biology Letters 8, 430–433. https://doi.org/10.1098/rsbl.2011.1014
Correll, N., Sempo, G., De Meneses, Y.L., Halloy, J., Deneubourg, J.L., Martinoli, A. 2006. SwisTrack: A tracking tool for multi-unit robotic and biological systems. IEEE International Conference on Intelligent Robots and Systems 2185–2191. https://doi.org/10.1109/IROS.2006.282558
de la Peña-Lastra, S. 2009. Efecto del jabalí (Sus scrofa) sobre ecosistemas insulares: el caso concreto de los hongos en la isla de Cortegada. Micología 14, 14–18
Detrain, C., Pereira, H., Fourcassié, V. 2019. Differential responses to chemical cues correlate with task performance in ant foragers. Behavioral Ecology and Sociobiology 73, 107. https://doi.org/10.1007/s00265-019-2717-5
Diagne, C., Leroy, B., Vaissière, A.C., Gozlan, R.E., Roiz, D., Jarić, I., Salles, J.M., et al. 2021. High and rising economic costs of biological invasions worldwide. Nature 592(7855), 571–576. https://doi.org/10.1038/s41586-021-03405-6
Doria, M.D., Morand-Ferron, J., Bertram, S.M. 2019. Spatial cognitive performance is linked to thigmotaxis in field crickets. Animal Behaviour 150, 15–25. https://doi.org/10.1016/j.anbehav.2019.01.022
Dussutour, A., Deneubourg, J.L., Fourcassié, V. 2005. Amplification of individual preferences in a social context: The case of wall-following in ants. Proceedings of the Royal Society B: Biological Sciences 272, 705–714. https://doi.org/10.1098/rspb.2004.2990
Foster, J.B. 1964. Evolution of mammals on islands. Nature 202, 234–235. https://doi.org/10.1038/202234a0
Fowler, H., Forti, L., Brandão, C., Delabie, J.H.C., Vasconcelos, HL. 1991. Ecologia nutricional de formigas, En: Panizzi, A.R., Parra, J.R.P. (eds.), Ecologia Nutricional de Insetos e suas Implicações no Manejo de Pragas, pp. 131-223. Manole e CNPq, São Paulo, Brasil.
Fuentes, M.A., Escoriza, D. 2015. Natrix maura (viperine snake) marine foraging. The Herpetological Bulletin 134, 31–32
Galán, P. 2012. Natrix maura en el medio marino de las Islas Atlánticas de Galicia. Boletín de la Asociación Herpetológica Española 23, 38–43.
Gibb, H., Parr, C.L. 2013. Does structural complexity determine the morphology of assemblages? An experimental test on three continents. PLoS One 8e64005. https://doi.org/10.1371/journal.pone.0064005
Giraud, T., Pedersen, J.S., Keller, L. 2002. Evolution of supercolonies: The Argentine ants of southern Europe. Proceedings of the National Academy of Sciences of the United States of America 99, 6075–6079. https://doi.org/10.1073/pnas.092694199
Global Invasive Species Database (GISD). https://www.iucngisd.org. [Accedido en noviembre 2024].
Heaneyl, L.R. 1978. Island area and body size of insular mammals: evidence from the tri-colored squirrel (Callosciurus prevosti) of Southeast Asia. Evolution 32, 29–44. https://doi.org/10.1111/j.1558-5646.1978.tb01096.x
Hee, J.J., Holway, D.A., Suarez, A.V., Case, T.J. 2000. Role of propagule size in the success of incipient colonies of the invasive Argentine ant. Conservation Biology 14(2), 559-563.https://doi.org/10.1046/j.1523-1739.2000.99040.x
Helanterä, H. 2022. Supercolonies of ants (Hymenoptera: Formicidae): ecological patterns, behavioural processes and their implications for social evolution. Myrmecological News 32, 1–22. https://doi.org/10.25849/myrmecol.news_032:001
Helanterä, H., Strassmann, J.E., Carrillo, J., Queller, D.C. 2009. Unicolonial ants: where do they come from, what are they and where are they going? Trends in Ecology and Evolution 24(6), 341–349. https://doi.org/10.1016/j.tree.2009.01.013
Heller, N.E. 2004. Colony structure in introduced and native populations of the invasive Argentine ant, Linepithema humile. Insectes Socieaux 51, 378–386. https://doi.org/10.1007/s00040-004-0770-0
Hirata, M., Hasegawa, O., Toita, T., Higashi, S. 2008. Genetic relationships among populations of the Argentine ant Linepithema humile introduced into Japan. Ecological Research 23(5), 883–888. https://doi.org/10.1007/s11284-007-0450-4
Holway, D.A. 1995. Distribution of the Argentine Ant (Linepithema humile) in Northern California. Conservation Biology, 9, 1634–1637. https://doi.org/10.1046/j.1523-1739.1995.09061634.x
Hulme, P.E. 2017. Climate change and biological invasions: evidence, expectations, and response options. Biological Reviews 92(3), 1297-1313. https://doi.org/10.1111/brv.12282
Kamaru, D.N., Palmer, T.M., Riginos, C., Ford, A.T., Belnap, J., Chira, R.M., Githaiga, J.M., et al. 2024. Disruption of an ant-plant mutualism shapes interactions between lions and their primary prey. Science 383(6681), 433-438. https://doi.org/10.1126/science.adg1464
Kemp, D.J., Wiklund, C. 2004. Residency effects in animal contests. Proceedings of the Royal Society B: Biological Sciences 271, 1707–1711. https://doi.org/10.1098/rspb.2004.2775
Keresztes, K.K., Csata, E., Lunka, T.A., Markó, B. 2020. Friend or foe? Differential aggression towards neighbors and strangers in the ant Liometopum microcephalum (Hymenoptera: Formicidae). Entomological Science 23(4), 351–358. https://doi.org/10.1111/ens.12433
Lapiedra, O., Sayol, F., Garcia-Porta, J., Sol, D. 2021. Niche shifts after island colonization spurred adaptive diversification and speciation in a cosmopolitan bird clade. Proceedings of the Royal Society B 288(1958), 20211022. https://doi.org/10.1098/rspb.2021.1022
Lenth, R. 2025. _emmeans: Estimated Marginal Means, aka Least-Squares Means_. R package version 1.11.2, https://CRAN.R-project.org/package=emmeans
Liang, D., Silverman, J. 2000. “You are what you eat”: Diet modifies cuticular hydrocarbons and nestmate recognition in the Argentine ant, Linepithema humile. Naturwissenschaften 87, 412–416. https://doi.org/10.1007/s001140050752
Lomolino, M.V., Sax, D.F., Palombo, M.R., van der Geer, A.A. 2012. Of mice and mammoths: Evaluations of causal explanations for body size evolution in insular mammals. Journal of Biogeography 39, 842–854. https://doi.org/10.1111/j.1365-2699.2011.02656.x
Lopez, B.E., Allen, J.M., Dukes, J.S., Lenoir, J., Vilà, M., Blumenthal, D.M., Beaury, E.M., et al. 2022. Global environmental changes more frequently offset than intensify detrimental effects of biological invasions. Proceedings of the National Academy of Sciences 119(22), e2117389119. https://doi.org/10.1073/pnas.211738911
Lowe, S., Browne, M, Boudjelas, S, de Poorter, M. 2000. 100 of the World’s Worst Invasive Alien Species A selection from the Global Invasive Species Database. www.issg.org/booklet.pdf
MacArthur, R.H., Wilson, E.O. 1967. The theory of island biogeography (Vol. 1), Princeton Landmarks in Biology. Princenton University Press,
Martins, M.N. 1907. Une fourmi terrible envahissant l'Europe (Iridomyrmex humilis MAYR). Brotéria, Series Zoología 6, 101-102.
Mayr, E. 1954. Change of genetic environment and evolution. In: Huxley, J.S., Hardy, A.C., Ford, E.B. (eds.), Evolution as a Process, pp. 156-80. George Allen & Unwin Ltd. London, UK.
Menke, S.B., Fisher, R.N., Jetz, W., Holway, D.A. 2007. Biotic and abiotic controls of argentine ant invasion success at local and landscape scales. Ecology 88(12), 3164–3173. https://doi.org/10.1890/07-0122.1
Mlot, N.J., Tovey, C.A., Hu, D.L. 2011. Fire ants self-assemble into waterproof rafts to survive floods. Proceedings of the National Academy of Sciences of the United States of America 108, 7669–7673. https://doi.org/10.1073/pnas.1016658108
Mothapo, N.P., Wossler, T.C. 2011. Behavioural and chemical evidence for multiple colonisation of the Argentine ant, Linepithema humile, in the Western Cape, South Africa. BMC Ecology 11, 6. https://doi.org/10.1186/1472-6785-11-6
Muller, C.A., Manser, M.B. 2007. ‘Nasty neighbours’ rather than ‘dear enemies’ in a social carnivore. Proceedings of the Royal Society B, 274, 959–965. https://doi.org/10.1098/rspb.2006.0222
Nei, M., Maruyama, T., Chakraborty, R. 1975. The bottleneck effect and genetic variability in populations. Evolution 29(1), 1-10. https://doi.org/10.1111/j.1558-5646.1975.tb00807.x
Newey, P.S., Robson, S.K., Crozier, R.H. 2010. Weaver ants Oecophylla smaragdina encounter nasty neighbors rather than dear enemies. Ecology, 91(8), 2366-2372. https://doi.org/10.1890/09-0561.1
Organismo Autónomo Parques Nacionales 2022. Informe de resultados para el periodo 2020-2022. Parque Nacional de las Islas Atlánticas de Galicia. Red de Parques Nacionales. Ministerio para la Transición Ecológica y el Reto Demográfico.
Palmer, M. 2002. Testing the “island rule” for a tenebrionid beetle (Coleoptera, Tenebrionidae). Acta Oecologica 23, 103–107. https://doi.org/10.1016/S1146-609X(02)01140-2
Peixoto, P.E.C., Benson, W.W. 2012. Influence of previous residency and body mass in the territorial contests of the butterfly Hermeuptychia fallax (Lepidoptera: Satyrinae). Journal of Ethology 30, 61–68. https://doi.org/10.1007/s10164-011-0294-9
Pyšek, P., Blackburn, T.M., García-Berthou, E., Perglová, I., Rabitsch, W. 2017. Displacement and local extinction of native and endemic species. En: Impact of biological invasions on ecosystem services 157-175. https://doi.org/10.1007/978-3-319-45121-3_10
Pyšek, P., Hulme, P.E., Simberloff, D., Bacher, S., Blackburn, T.M., Carlton, J.T., Dawson, W., et al. 2020. Scientists' warning on invasive alien species. Biological Reviews 95(6), 1511-1534. https://doi.org/10.1111/brv.12627
Pontin, A.J. 1961. Population stabilization and competition between the ants Lasius flavus (F.) and L. niger (L.). British Ecological Society 30, 47–54. https://doi.org/10.2307/2112
R Core Team 2021. R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. URL https://www.R-project.org/
Roy, H.E., Pauchard, A., Stoett, P., Renard Truong, T. 2023. The thematic assessment report on invasive alien species and their control: Summary for policymakers. IPBES. https://doi.org/10.5281/zenodo.7430682
Sanmartín-Villar, I., Jeanson, R. 2021. Early social context does not influence behavioral variation at adulthood in ants. Current Zoology 68(3), pp. 335-344. https://doi.org/10.1093/cz/zoab063
Sanmartín-Villar, I., Cruz da Silva, E., Chiara, V., Cordero-Rivera, A., Lorenzo-Carballa, M.O. 2022. Genetic divergence and aggressiveness within a supercolony of the invasive ant Linepithema humile. NeoBiota 77, 125-153. https://doi.org/10.3897/neobiota.77.90852
Sax, D.F., Gaines, S.D. 2008. Species invasions and extinction: the future of native biodiversity on islands. Proceedings of the National Academy of Sciences 105 (supplement_1), 11490-11497. https://doi.org/10.1073/pnas.0802290105
Shreeve, T.G. 1987. The mate location behaviour of the male speckled wood butterfly, Pararge aegeria, and the effect of phenotypic differences in hind-wing spotting. Animal Behaviour 35, 682–690. https://doi.org/10.1016/S0003-3472(87)80104-5
Siddiqui, J.A., Bamisile, B.S., Khan, M.M., Islam, W., Hafeez, M., Bodlah, I., Xu, Y. 2021. Impact of invasive ant species on native fauna across similar habitats under global environmental changes. Environmental Science and Pollution Research 28, 54362-54382. https://doi.org/10.1007/s11356-021-15961-5
Sneddon, L.U. 2003. The bold and the shy: Individual differences in rainbow trout. Journal of Fish Biology 62, 971–975. https://doi.org/10.1046/j.1095-8649.2003.00084.x
Suarez, A.V., Holway, D.A., Case, T.J. 2001. Patterns of spread in biological invasions dominated by long-distance jump dispersal: Insights from argentine ants. Proceedings of the National Academy of Sciences of the United States of America 98, 1095–1100. https://doi.org/10.1073/pnas.98.3.1095
Thomas, M.L., Payne-Makrisâ, C.M., Suarez, A.V., Tsutsui, N.D., Holway, D.A. 2007. Contact between supercolonies elevates aggression in Argentine ants. Insectes Socieaux 54, 225–233. https://doi.org/10.1007/s00040-007-0935-8
Thomas, M.L., Payne-Makrisâ, C.M., Suarez, A.V., Tsutsui, N.D., Holway, D.A. 2006. When supercolonies collide: Territorial aggression in an invasive and unicolonial social insect. Molecular Ecology 15, 4303–4315. https://doi.org/10.1111/j.1365-294X.2006.03038.x
Trigos-Peral, G., Abril, S., Angulo, E. 2021. Behavioral responses to numerical differences when two invasive ants meet: the case of Lasius neglectus and Linepithema humile. Biological Invasions 23, 935-953. https://doi.org/10.1007/s10530-020-02412-4
Tsutsui, N.D., Suarez, A.V., Grosberg, R.K. 2003. Genetic diversity, asymmetrical aggression, and recognition in a widespread invasive species. Proceedings of the National Academy of Sciences of the United States of America 100, 1078–1083. https://doi.org/10.1073/pnas.0234412100
Valle, F.P. 1970. Effects of strain, sex, and illumination on open-field behavior of rats. American Journal of Psychology 83, 103–111. https://doi.org/10.2307/1420860
Velo-Antón, G., Cordero-Rivera, A. 2017. Ethological and phenotypic divergence in insular fire salamanders: diurnal activity mediated by predation? Acta Ethologica 20, 243-253. https://doi.org/10.1007/s10211-017-0267-2
Velo-Antón, G., Santos, X., Sanmartín‐Villar, I., Cordero-Rivera, A., Buckley, D. 2015. Intraspecific variation in clutch size and maternal investment in pueriparous and larviparous Salamandra salamandra females. Evolutionary Ecology 29, 185–204. https://doi.org/10.1007/s10682-014-9720-0
Velo-Antón, G., Comesaña Ledo, M., Pardavila, X. 2025. Aposematism vs. scavenging? Camera trapping unveils low and seasonal-dependent consumption of toxic salamander carcasses by wild boars. Amphibia-Reptilia, in press, 1–12. https://doi.org/10.1163/15685381-bja10211
Walsh, R.N., Cummins, R.A. 1976. The open-field test: A critical review. Psychological Bulletin 83, :482–504. https://doi.org/10.1037//0033-2909.83.3.482
Wetterer, J.K., Wetterer, A.L. 2006. A disjunct Argentine ant metacolony in Macaronesia and southwestern Europe. Biological Invasions 8, 1123-1129. https://doi.org/10.1007/s10530-005-8641-9
Wilson, E.O. 1975 Sociobiology: the new synthesis. Cambridge, Harvard University Press
Yates, M.L., Andrew, N.R., Binns, M., Gibb, H. 2014. Morphological traits: predictable responses to macrohabitats across a 300 km scale. PeerJ 2:e271. https://doi.org/10.7717/peerj.271
Zhao, Y., Dunn, R.R., Zhou, H., Si, X., Ding, P. 2020. Island area, not isolation, drives taxonomic, phylogenetic and functional diversity of ants on land-bridge islands. Journal of Biogeography 47, 1627–1637. https://doi.org/10.1111/jbi.13860
Anexo / Appendix
Tabla A1. Resultados de los análisis post hoc efectuados para cada una de las variables analizadas. COR: Isla de Cortegada, TRA: Trabanca, ARO: Isla de Arousa, VIL: Vilanova de Arousa, TOX: Isla de A Toxa, LAN: A Lanzada. PO: Pontevedra. RE: Reboreda. C: Control (enfrentamiento de hormigas obreras del mismo nido). CC: Continente - Continente (enfrentamiento de obreras de diferente colonia de localidades continentales). ICP: Isla - Continente Próximo (enfrentamiento de obreras de colonias insulares con obreras de localidades continentales próximas del grupo genético norte). II: Isla - Isla (enfrentamiento de obreras de diferente isla). ICD: Continente Distante (enfrentamiento de obreras insulares con obreras de colonias de localidades continentales distantes del grupo genético norte). IS: Isla - Sur (enfrentamiento de obreras insulares con obreras de colonias de localidades continentales distantes del asumido grupo genético sur; véase Sanmartín-Villar et al. 2022).
Table A1. Results of the post hoc analyses performed for each of the variables analysed. COR: Cortegada Island, TRA: Trabanca, ARO: Arousa Island, VIL: Vilanova de Arousa, TOX: A Toxa Island, LAN: A Lanzada. PO: Pontevedra. RE: Reboreda. C: Control (confrontation between worker ants from the same nest). CC: Continent - Continent (confrontation between workers from different colonies in continental locations). ICP: Island - Nearby Continent (confrontation between workers from island colonies and workers from nearby continental locations in the northern genetic group). II: Island - Island (confrontation between workers from different islands). ICD: Distant Continent (confrontation between island workers and workers from colonies in distant continental locations of the northern genetic group). IS: Island - South (confrontation between island workers and workers from colonies in distant continental locations of the assumed southern genetic group; see Sanmartín-Villar et al. 2022).
|
Variable |
Comparación |
Estimación |
SE |
GL |
t ratio |
p valor |
|
Tamaño |
ARO - COR |
0.034 |
0.005 |
192 |
6.467 |
<0.001 |
|
ARO - LAN |
0.024 |
0.005 |
192 |
4.619 |
<0.001 |
|
|
ARO - PO |
0.012 |
0.005 |
192 |
2.353 |
0.271 |
|
|
ARO - RE |
0.012 |
0.005 |
192 |
2.224 |
0.342 |
|
|
ARO - TOX |
0.002 |
0.005 |
192 |
-0.462 |
1.000 |
|
|
ARO - TRA |
0.028 |
0.005 |
192 |
5.312 |
<0.001 |
|
|
ARO - VIL |
0.024 |
0.005 |
192 |
4.619 |
<0.001 |
|
|
COR - LAN |
-0.010 |
0.005 |
192 |
-1.848 |
0.589 |
|
|
COR - PO |
-0.021 |
0.005 |
192 |
-4.113 |
0.001 |
|
|
COR - RE |
-0.022 |
0.005 |
192 |
-4.243 |
<0.001 |
|
|
COR - TOX |
-0.031 |
0.005 |
192 |
6.005 |
<0.001 |
|
|
COR - TRA |
-0.006 |
0.005 |
192 |
-1.155 |
0.943 |
|
|
COR - VIL |
-0.010 |
0.005 |
192 |
-1.848 |
0.589 |
|
|
LAN - PO |
-0.011 |
0.005 |
192 |
-2.266 |
0.318 |
|
|
LAN - RE |
-0.012 |
0.005 |
192 |
-2.395 |
0.250 |
|
|
LAN - TRA |
0.004 |
0.005 |
192 |
0.693 |
0.997 |
|
|
LAN - VIL |
0.000 |
0.005 |
192 |
0.0 |
1.000 |
|
|
PO - RE |
-0.001 |
0.005 |
192 |
-0.13 |
1.000 |
|
|
PO - TRA |
0.015 |
0.005 |
192 |
2.959 |
0.067 |
|
|
PO - VIL |
0.012 |
0.005 |
192 |
2.266 |
0.318 |
|
|
RE - TRA |
0.016 |
0.005 |
192 |
3.088 |
0.047 |
|
|
RE - VIL |
0.012 |
0.005 |
192 |
2.395 |
0.250 |
|
|
TOX - LAN |
0.022 |
0.005 |
192 |
4.157 |
0.001 |
|
|
TOX - PO |
0.010 |
0.005 |
192 |
1.891 |
0.559 |
|
|
TOX - RE |
0.009 |
0.005 |
192 |
1.762 |
0.647 |
|
|
TOX - TRA |
0.025 |
0.005 |
192 |
4.85 |
<0.001 |
|
|
TOX - VIL |
0.022 |
0.005 |
192 |
4.157 |
0.001 |
|
|
TRA - VIL |
-0.004 |
0.005 |
192 |
-0.693 |
0.997 |
|
|
Locomoción |
ARO - COR |
-0.058 |
0.039 |
282 |
-1.497 |
0.667 |
|
ARO - LAN |
-0.068 |
0.038 |
282 |
-1.769 |
0.488 |
|
|
ARO - TOX |
-0.167 |
0.039 |
282 |
-4.335 |
<0.001 |
|
|
ARO - TRA |
-0.045 |
0.038 |
282 |
-1.196 |
0.839 |
|
|
ARO - VIL |
-0.153 |
0.038 |
282 |
-4.003 |
0.001 |
|
|
COR - LAN |
-0.010 |
0.038 |
282 |
-0.264 |
1.000 |
|
|
COR - TOX |
-0.110 |
0.039 |
282 |
-2.838 |
0.054 |
|
|
COR - TRA |
0.012 |
0.038 |
282 |
0.324 |
1.000 |
|
|
COR - VIL |
-0.095 |
0.038 |
282 |
-2.490 |
0.131 |
|
|
LAN - TOX |
-0.099 |
0.038 |
282 |
-2.588 |
0.104 |
|
|
LAN - TRA |
0.022 |
0.038 |
282 |
0.594 |
0.991 |
|
|
LAN - VIL |
-0.085 |
0.038 |
282 |
-2.237 |
0.224 |
|
|
TOX - TRA |
0.122 |
0.038 |
282 |
3.205 |
0.019 |
|
|
TOX - VIL |
0.014 |
0.038 |
282 |
0.377 |
0.999 |
|
|
TRA - VIL |
-0.107 |
0.038 |
282 |
-2.857 |
0.052 |
|
|
Tigmotaxis |
ARO - COR |
-0.048 |
0.045 |
282 |
-1.080 |
0.889 |
|
ARO - LAN |
-0.129 |
0.045 |
282 |
-2.891 |
0.047 |
|
|
ARO - TOX |
-0.061 |
0.045 |
282 |
-1.353 |
0.755 |
|
|
ARO - TRA |
-0.140 |
0.044 |
282 |
-3.173 |
0.021 |
|
|
ARO - VIL |
-0.067 |
0.044 |
282 |
-1.508 |
0.659 |
|
|
COR - LAN |
-0.080 |
0.045 |
282 |
-1.805 |
0.464 |
|
|
COR - TOX |
-0.012 |
0.045 |
282 |
-0.272 |
1.000 |
|
|
COR - TRA |
-0.092 |
0.044 |
282 |
-2.076 |
0.303 |
|
|
COR - VIL |
-0.018 |
0.044 |
282 |
-0.417 |
0.998 |
|
|
LAN - TOX |
0.068 |
0.045 |
282 |
1.531 |
0.645 |
|
|
LAN - TRA |
-0.011 |
0.044 |
282 |
-0.255 |
1.000 |
|
|
LAN - VIL |
0.062 |
0.044 |
282 |
1.405 |
0.724 |
|
|
TOX - TRA |
-0.079 |
0.044 |
282 |
-1.799 |
0.468 |
|
|
TOX - VIL |
-0.006 |
0.044 |
282 |
-0.141 |
1.000 |
|
|
TRA - VIL |
0.073 |
0.044 |
282 |
1.675 |
0.549 |
|
|
Mortalidad |
C - CC |
-0.167 |
1.94 |
21 |
-0.086 |
1.000 |
|
C - ICP |
-7.500 |
1.94 |
21 |
-3.871 |
0.010 |
|
|
C - II |
0.833 |
1.94 |
21 |
0.430 |
0.998 |
|
|
C - ICD |
0.500 |
1.58 |
21 |
0.316 |
1.000 |
|
|
C - IS |
-2.333 |
1.58 |
21 |
-1.475 |
0.683 |
|
|
CC - ICP |
-7.333 |
2.24 |
21 |
-3.278 |
0.037 |
|
|
CC - II |
1.000 |
2.24 |
21 |
0.447 |
0.997 |
|
|
CC - ICD |
0.667 |
1.94 |
21 |
0.344 |
0.999 |
|
|
CC – IS |
-2.167 |
1.94 |
21 |
-1.118 |
0.868 |
|
|
ICP – II |
8.333 |
2.24 |
21 |
3.725 |
0.014 |
|
|
ICP – ICD |
8.000 |
1.94 |
21 |
4.129 |
0.006 |
|
|
ICP - IS |
5.167 |
1.94 |
21 |
2.667 |
0.125 |
|
|
II - ICD |
-0.333 |
1.94 |
21 |
-0.172 |
1.000 |
|
|
II - IS |
-3.167 |
1.94 |
21 |
-1.634 |
0.586 |
|
|
ICD - IS |
-2.833 |
1.58 |
21 |
-1.791 |
0.492 |