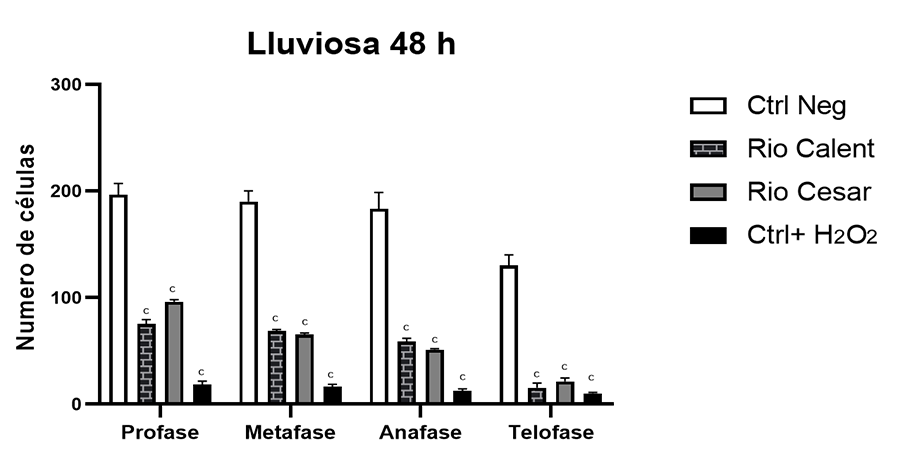
Tabla 4.
Parámetro de formación de micronúcleos y muerte celular en bulbos de A. cepa
expuestos a muestras de agua recolectadas para los diferentes grupos de estudio
en la época lluviosa. Los datos se presentan como media ± DE. ***Significativo
p < 0.001 en relación con el control negativo; ANOVA, post hoc de Dunnett. Control negativo = agua; Control positivo = H2O2.
Table
4. Micronucleus formation and cell death parameters
in A. cepa bulbs exposed to water samples collected for the different
study groups during the rainy season. Data are presented as mean ± SD.
Significant p < 0.001 compared to the negative control; ANOVA, Dunnett's
post hoc test. Negative control = water; Positive control = H₂O₂.
|
Periodo de exposición
|
Grupo de estudio
|
N
|
Formación de micronúcleos
|
Muerte
(desintegración nuclear)
|
|
24
h
|
Control
negativo
|
5
|
0.8
± 0.5
|
0.5
± 0.1
|
|
Rio
Calenturitas
|
5
|
4.4
±2.2***
|
6.4
± 3.3***
|
|
Rio
Cesar
|
5
|
3.3
± 2.9***
|
5.5
± 2.9***
|
|
Control
positivo
|
5
|
8.5
± 5.3***
|
8.5
± 6.2***
|
|
48
h
|
Control
negativo
|
5
|
0.9
± 0.6
|
0.8
± 0.1
|
|
Rio
Calenturitas
|
5
|
7.0
± 5.3***
|
7.8
± 4.3***
|
|
Rio
Cesar
|
5
|
4.0
± 3.0***
|
6.7
± 3.5***
|
|
Control
positivo
|
5
|
9.8±
7.8***
|
10.2
± 5.8 ***
|
***Significativo p < 0.001 en relación con el control negativo; ANOVA, post hoc de Dunnett. Control negativo = agua;
Control positivo = H2O2.
El análisis mediante espectrofotometría de absorción
atómica (Tabla 5) reveló la presencia de elementos
como arsénico (As) y mercurio (Hg) en el Río Calenturitas durante la temporada
seca, mientras que en la temporada lluviosa se detectó únicamente mercurio. En
el caso del Río Cesar, tanto en la temporada seca como en la lluviosa, se
encontraron concentraciones de estos elementos que superan los límites
permitidos para aguas de afluentes, lo que evidencia un grave problema de
contaminación que persiste independientemente de las variaciones estacionales.
Tabla 5. Análisis por
Espectrofotometría de absorción atómica de elementos químicos en las muestras
de agua colectada en época seca y lluviosa en el Río Calenturitas y Río Cesar. Los valores son media ± DE.
Table
5. Analysis by Atomic Absorption Spectrophotometry
of chemical elements in water samples collected during the dry and rainy
seasons in the Calenturitas River and Cesar River. The values are mean ± SD.
Los valores son media ± DE
Discusión
La alarmante presencia de contaminantes en cuerpos de agua
representa una amenaza silenciosa para la biodiversidad y la salud humana (Lin et al. 2022). En este contexto, nuestro estudio se
centró en la evaluación del potencial genotóxico del agua de los ríos Cesar y
Calenturitas en la región de La Loma, Colombia, utilizando A. cepa como
modelo experimental. Los resultados evidenciaron un impacto significativo en el
crecimiento y la división celular de A. cepa tras la exposición al agua
recolectada.
Estos resultados son consistentes con lo descrito por Ibáñez et al. (2022) sobre los efectos genotóxicos de
aguas superficiales usadas para riego y de Nunes et al.
(2011), quienes evaluaron muestras de agua recolectadas en un río bajo
efectos de vertimientos y actividades antropogénicas.
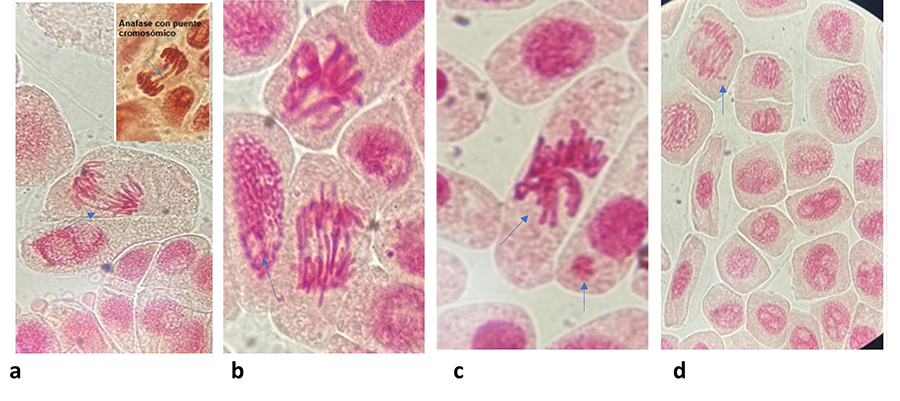
Las alteraciones cromosómicas observadas en este estudio,
como los puentes cromosómicos, desintegración nuclear, cromosomas pegajosos y
formación de micronúcleos, han sido ampliamente documentadas como indicadores
de daño genético (Kassa 2021). Las roturas cromosómicas
pueden ocurrir cuando los agentes genotóxicos interfieren con la estructura del
ADN, provocando la ruptura de la doble hélice durante la replicación o la
división celular (Sabeen et al. 2020). Los cromosomas
pegajosos son el resultado de la condensación anormal de la cromatina, a menudo
debido a la acción de sustancias químicas que alteran las proteínas histonas o
los enlaces en el ADN (Banti y Hadjikakou 2019;
Kassa 2021; Wijeyaratne
y Wadasinghe 2019a).
La desintegración nuclear observada en este estudio es
indicativa de muerte celular (Sabeen et al. 2020),
evidenciando el potencial genotóxico y citotóxico de los contaminantes
presentes en el agua de los ríos estudiados. Además, los puentes cromosómicos
en anafase son típicos de fusiones incorrectas entre cromosomas o entre
fragmentos cromosómicos, lo que sugiere fallos en los mecanismos de reparación
del ADN (Banti y Hadjikakou 2019; Kassa 2021). Estos puentes pueden generar tensiones
mecánicas durante la división celular, lo que podría llevar a roturas
adicionales y a la perpetuación del daño en las células hijas (Banti y Hadjikakou 2019; Wijeyaratne y Wadasinghe 2019b).
La reducción en la longitud de las raíces de A. cepa
tras la exposición a las muestras de agua contaminada sugiere un efecto
inhibidor acumulativo de los contaminantes sobre el desarrollo radicular (Nunes et al. 2011). Esta reducción no solo compromete la
estabilidad y la absorción de nutrientes en las plantas, sino que también puede
ser un indicador temprano de toxicidad ambiental, sugiriendo posibles efectos
adversos sobre los ecosistemas acuáticos en su conjunto (Akinboro
et al. 2011; Kassa 2021). No obstante, aunque el
ensayo con A. cepa es una herramienta útil para detectar genotoxicidad,
algunos estudios (Bonciu et al. 2018; Wijeyaratne
y Wadasinghe 2019a; Alias et al. 2023) han
señalado limitaciones en la extrapolación de estos hallazgos a organismos de
mayor complejidad biológica. Esto resalta la necesidad de complementar estos
resultados con estudios en otros modelos biológicos para obtener una visión más
integral del impacto ambiental de estos contaminantes. Adicionalmente, la
significativa inducción de micronúcleos en los bulbos expuestos al agua de
ambas localidades refuerza la hipótesis de que los contaminantes presentes en
estos cuerpos de agua pueden generar inestabilidad genética.
Ha sido ampliamente descrito que la formación de
micronúcleos es un indicador clave de daño en el ADN y de posibles efectos
mutagénicos (Banti y Hadjikakou 2019; Fenech et al. 2020). Asimismo, la desintegración nuclear
observada sugiere pudo haber ocurrido un daño genético tan severo que activó
los mecanismos de apoptosis. Este proceso es un mecanismo para eliminar células
irreparablemente afectadas, previniendo así la proliferación de células con
alteraciones genéticas que podrían comprometer la integridad del organismo (De Zio
et al. 2013).
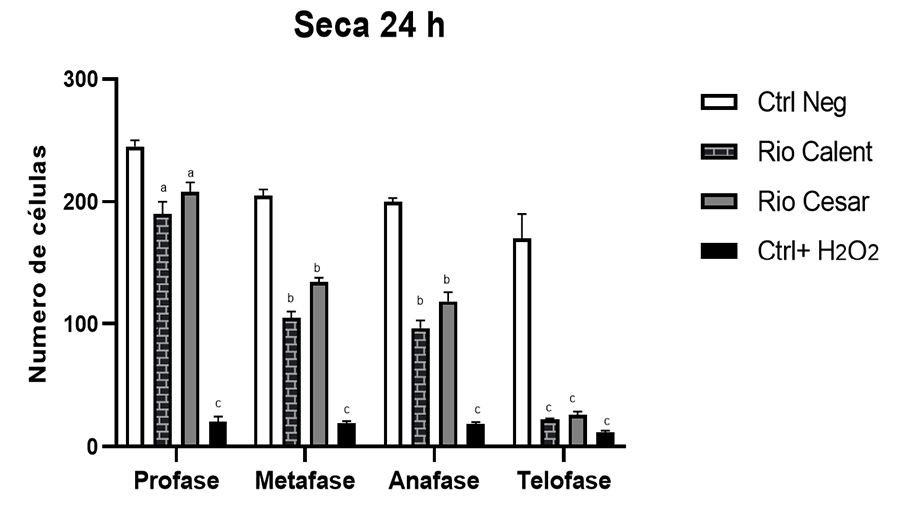
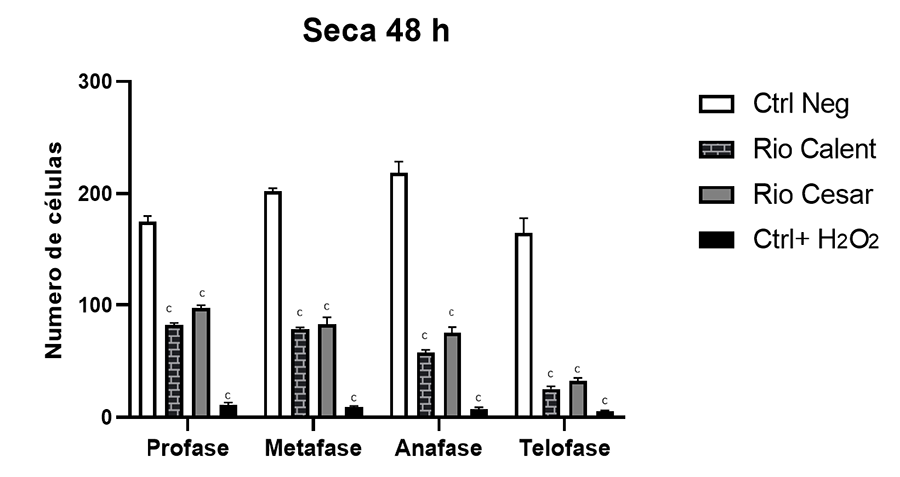
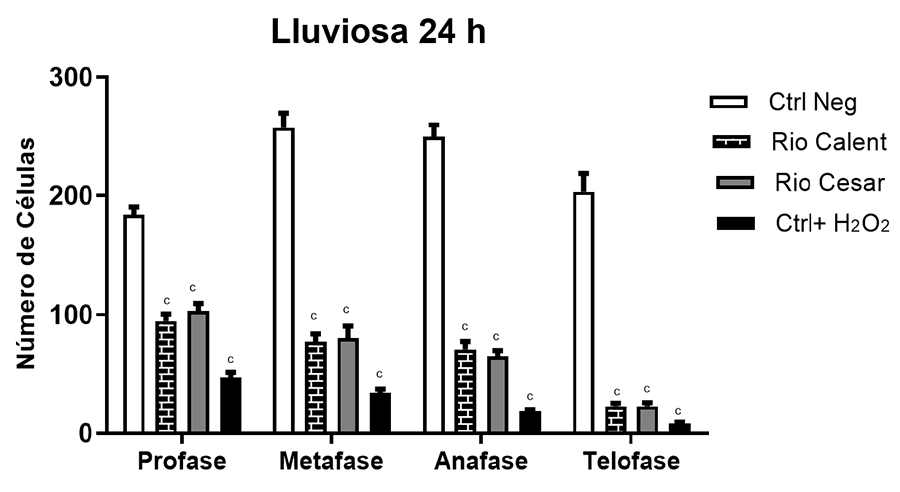
Otro punto importante en este estudio fue evaluar si
existían variaciones en la concentración de contaminantes dependiendo de la
época seca o lluviosa. Aunque se podría pensar que durante la época lluviosa
los contaminantes provenientes de actividades antropogénicas se diluyen más
debido al aumento del caudal de los ríos y, por ende, se esperarían menores
efectos, los hallazgos indicaron lo contrario. Esto podría deberse a varios
factores. En primer lugar, es posible que, aunque haya una mayor dilución de
contaminantes individuales, el aumento del volumen de agua también arrastre una
mayor cantidad de contaminantes desde diversas fuentes, resultando en una carga
total elevada de sustancias nocivas. Además, ciertos contaminantes, pese a su
dilución, pueden mantener su capacidad de interferir en procesos biológicos
críticos como la división celular, tal como ha sido reportado por otros
estudios (Dutta et al. 2018; Kassa
2021).
Otro factor a considerar es la posibilidad de un vertimiento
constante de contaminantes que ocurre independientemente de la época del año.
Esto sugiere que, incluso con la dilución adicional en la temporada lluviosa,
la presencia continua de estas sustancias tóxicas puede seguir siendo
suficientemente alta como para provocar efectos adversos significativos. Este
fenómeno también podría estar influenciado por la presencia de contaminantes
persistentes o bioacumulativos que no se diluyen fácilmente o que incluso
pueden concentrarse en ciertos ambientes acuáticos (Pelcová
et al. 2022). Además, la interacción entre diferentes tipos de
contaminantes en condiciones de mayor caudal podría generar nuevos metabolitos
tóxicos o sinergias que intensifiquen los efectos nocivos sobre las células (Lin et al. 2022).
La presencia de mercurio y arsénico en estas aguas es
alarmante debido a sus efectos tóxicos y persistentes en la salud ambiental y
humana. El mercurio es un potente neurotóxico que se libera al ambiente
principalmente a través de la minería de oro y carbón, acumulándose en los
ecosistemas acuáticos en forma de metilmercurio, una de sus formas más tóxicas
(Novo et al. 2021). Este compuesto se bioacumula en la
cadena alimentaria, afectando gravemente a los organismos acuáticos y
provocando daños neurológicos en humanos, especialmente en niños y fetos (Al-Sulaiti et al. 2022). En Colombia, la minería
ilegal de oro utiliza mercurio para amalgamar el oro, liberando este metal
tóxico al medio ambiente (Ministerio de Ambiente y
Desarrollo Sostenible 2018). Como agente genotóxico, el mercurio puede
inducir la formación de especies reactivas de oxígeno (ERO), causando daño en
el ADN, proteínas y lípidos, lo que puede llevar a mutaciones y muerte celular.
También puede unirse al ADN, alterando su estructura y afectando la replicación
y reparación, lo que puede resultar en mutaciones carcinogénicas o
teratogénicas (Wyatt et al. 2017). Asimismo, se ha
asociado con alteraciones en la expresión génica y la inducción de aberraciones
cromosómicas, contribuyendo al desarrollo de cáncer y defectos congénitos (Harding et al. 2018; Muñoz et al.
2023).
El arsénico, por su parte, es un metaloide tóxico que
ingresa a los ríos tanto por procesos naturales como la erosión, como por
actividades humanas, incluyendo la minería y el uso de pesticidas. En los
ecosistemas acuáticos, afecta a los organismos al interferir con su metabolismo
y provocar estrés oxidativo, reduciendo así las poblaciones de especies (Fatoki y Badmus 2022). En humanos, la exposición al
arsénico, especialmente a través del agua contaminada, puede causar cáncer de
piel, pulmón, vejiga y riñón, además de problemas cardiovasculares y
neurotóxicos (Jomova et al. 2011). Su acción
genotóxica incluye la inhibición de la reparación del ADN, alteraciones en la
metilación del ADN y efectos en la división celular, lo que conduce a anomalías
cromosómicas y proliferación celular descontrolada (Ganapathy
et al. 2018; Huang et al. 2019).
El impacto de la presencia de estos contaminantes en el agua
puede repercutir significativamente en la economía y las actividades de la
población local, afectando tanto la salud humana como la sostenibilidad de los
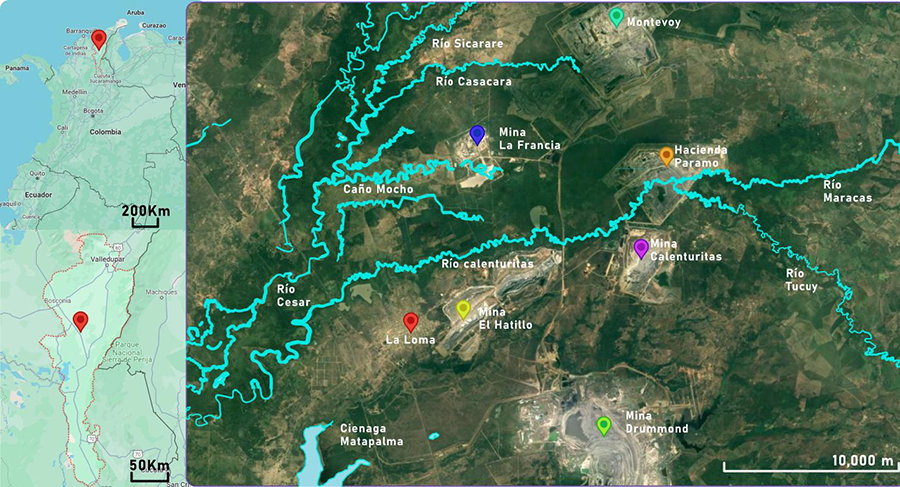
recursos naturales. En el corregimiento de La Loma se desarrollan diversas
actividades socioeconómicas, predominando la agricultura con cultivos de arroz,
maíz y palma de aceite, así como la minería de carbón, la ganadería y la pesca
artesanal de subsistencia (Gutierres Moreno et
al. 2011). Los habitantes han reportado una disminución significativa en la
producción ictiológica, lo que impacta negativamente la seguridad alimentaria y
la economía local. La contaminación derivada de la minería de carbón ha
contribuido a la reducción de peces, llevando al abandono progresivo de esta
actividad en algunos sectores debido a la escasez y la percepción de riesgo
asociado al consumo de peces contaminados (Gutierres
Moreno et al. 2011). Además, se han registrado denuncias de la comunidad
sobre irritaciones cutáneas y afecciones respiratorias, lo que podría estar
relacionado con la exposición prolongada a metales pesados y material
particulado derivado de actividades mineras (León-Mejía
et al. 2023a; León-Mejía et al. 2023b).
Otros factores que contribuyen a la presión sobre los
cuerpos de agua incluyen los vertimientos de aguas residuales domésticas e
industriales, desechos de la minería y operaciones de maquinaria pesada, además
de las aguas procedentes de lagunas de oxidación de municipios cercanos a los
ríos Cesar y Calenturitas (Gutierres Moreno et
al. 2011). Se ha identificado también un modelo agropecuario intensivo, en
el que el uso rutinario de agrotóxicos genera un arrastre constante de estos
compuestos hacia los cuerpos de agua a través de la escorrentía (Gutierres Moreno et al. 2011).
Estos hallazgos se enmarcan en el contexto global del
Antropoceno, una era caracterizada por la intensa influencia de las actividades
humanas sobre los ecosistemas (Willcock et al. 2023).
La contaminación detectada en esta región, resultado de prácticas extractivas y
agroindustriales, refleja un patrón observado en diversas geografías donde se
compromete la estabilidad de los sistemas eco-sociales y la capacidad de
regeneración de los recursos hídricos. En este sentido, la región analizada
puede ser considerada una "zona de sacrificio", dado que es un
territorio sometido a una presión ambiental sostenida debido a actividades
económicas que priorizan el beneficio inmediato sobre la sostenibilidad a largo
plazo (Rozo Castillo 2021). La persistencia de
contaminantes en los ríos Cesar y Calenturitas pone en evidencia cómo las
economías extractivas no solo afectan la biodiversidad local, sino que también
contribuyen al deterioro de los límites planetarios, amenazando la salud de los
ecosistemas y, en última instancia, la continuidad de la vida en estas
comunidades.
Conclusión
La exposición de A. cepa al agua contaminada de estos
ríos, con niveles significativos de mercurio y arsénico, resultó en una
disminución del índice mitótico, formación de micronúcleos, desintegración
nuclear (indicativo de muerte celular), disminución de la longitud de la raíz y
reducción en el número de células que completaron el ciclo celular, en
comparación con los controles. Estos hallazgos destacan el impacto genotóxico y
citotóxico de los contaminantes presentes en los cuerpos de agua analizados,
los cuales derivan de diversas actividades antropogénicas como la minería de
carbón y oro, el uso intensivo de agroquímicos en cultivos de arroz, maíz y
palma de aceite, el vertimiento de aguas residuales domésticas e industriales,
y la ganadería extensiva.
La confluencia de estas actividades en la región parece
haber generado niveles significativos de mercurio y arsénico en los cuerpos de
agua locales, persistiendo estos niveles elevados incluso durante la época
lluviosa. Esto sugiere que los procesos de contaminación son tan extensos que
mantienen concentraciones altas de tóxicos independientemente de las
variaciones estacionales en el volumen de agua. Estos resultados resaltan la
necesidad urgente de implementar medidas de control más estrictas, así como la
importancia de investigar los efectos a largo plazo de la exposición a estos
contaminantes en los ecosistemas acuáticos de Colombia.
Contribución de los autores
León-Mejía, G.: análisis formal, conceptualización,
investigación, metodología; Castro-Camacho, L.: curaduría de datos, redacción
del borrador original, revisión y edición; Franco Valencia, K.: análisis
formal, conceptualización, revisión y edición; Ruiz-Benítez, M.: administración
del proyecto, adquisición de fondos y recursos, conceptualización; Rodríguez
Tapia, J.: investigación, metodología, revisión y edición; Torres, F.:
conceptualización, revisión y edición, supervisión.
Disponibilidad de datos
Los datos que respaldan los resultados presentados en este
estudio forman parte de la tesis de maestría de Luz Adriana Castro Camacho.
Esta tesis se encuentra disponible en el repositorio institucional de la
Universidad Simón Bolívar y puede consultarse en el siguiente enlace: https://hdl.handle.net/20.500.12442/15210
Financiación,
permisos requeridos, potenciales conflictos de interés y agradecimientos
Este trabajo
fue financiado por la Universidad Simón Bolívar de Barranquilla, Colombia. No
se requirieron permisos específicos para la realización de esta investigación.
Los autores declaran no tener conflictos de interés.
Agradecemos a
los líderes sociales pertenecientes a la Junta de Acción Comunal de La Loma,
Cesar, por su valiosa colaboración en la identificación de los sitios de toma
de muestras y su orientación en el desarrollo de este trabajo.
Referencias
Akhtar, N.,
Syakir, M.I., Bhawani, S.A., Umar, K. 2021. Various Natural and Anthropogenic Factors
Responsible for Water Quality Degradation: A Review. Water 13(19)
2660. https://doi.org/10.3390/w13192660
Akinboro, A., Mohammed, K., Rathnasamy, S., Muniandy, V.R. 2011.
Genotoxicity Assessment of Water Samples from the Sungai Dua River in Pulau
Pinang, Malaysia, Using the Allium cepa Test. Tropical Life Sciences
Research 22(2) 23–35.
Alias, C., Feretti, D., Viola, G.V.C., Zerbini, I., Bisceglie, F.,
Pelosi, G., Zani, C., et al. 2023. Allium cepa tests: A plant-based tool for
the early evaluation of toxicity and genotoxicity of newly synthetized
antifungal molecules. Mutation Research/Genetic Toxicology and
Environmental Mutagenesis 889 503654. https://doi.org/10.1016/j.mrgentox.2023.503654
Al-Sulaiti, M.M.,
Soubra, L., Al-Ghouti, M.A. 2022. The Causes and Effects of Mercury and Methylmercury
Contamination in the Marine Environment: A Review. Current Pollution
Reports 8(3) 249–272. https://doi.org/10.1007/s40726-022-00226-7
Baines, C., Lerebours, A., Thomas, F., Fort, J., Kreitsberg, R.,
Gentes, S., Meitern, R., et al. 2021. Linking pollution and cancer in aquatic
environments: A review. Environment International 149
106391. https://doi.org/10.1016/j.envint.2021.106391
Banti, C., Hadjikakou, S. 2019. Evaluation of
Genotoxicity by Micronucleus Assay in vitro and by Allium cepa Test in
vivo. BIO-PROTOCOL 9(14). https://doi.org/10.21769/BioProtoc.3311
Bonciu, E., Firbas, P., Fontanetti, C.S., Wusheng, J.,
Karaismailoğlu, M.C., Liu, D., Menicucci, F., et al. 2018. An evaluation for
the standardization of the Allium cepa test as cytotoxicity and genotoxicity
assay. Caryologia 71(3) 191–209. https://doi.org/10.1080/00087114.2018.1503496
Czarnek, K., Tatarczak-Michalewska, M., Szopa, A.,
Klimek-Szczykutowicz, M., Jafernik, K., Majerek, D., Blicharska, E. 2023.
Bioaccumulation Capacity of Onion (Allium cepa L.) Tested with Heavy Metals in
Biofortification. Molecules 29(1) 101. https://doi.org/10.3390/molecules29010101
De Zio, D.,
Cianfanelli, V., Cecconi, F. 2013. New Insights into the Link Between DNA Damage and
Apoptosis. Antioxidants and Redox Signaling 19(6)
559–571. https://doi.org/10.1089/ars.2012.4938
Dourado, P.L.R., Rocha, M.P. da Roveda, L.M., Raposo, J.L., Cândido,
L.S., Cardoso, C.A.L., Morales, M.A.M., et al. 2016. Genotoxic and mutagenic
effects of polluted surface water in the midwestern region of Brazil using
animal and plant bioassays. Genetics and Molecular Biology 40(1)
123–133. https://doi.org/10.1590/1678-4685-gmb-2015-0223
Dutta, J., Ahmad, A., Singh, J. 2018. Study of industrial
effluents induced genotoxicity on Allium cepa L. Caryologia 71(2)
139–145. https://doi.org/10.1080/00087114.2018.1447631
Fatoki, J.O., Badmus, J.A. 2022. Arsenic as an
environmental and human health antagonist: A review of its toxicity and disease
initiation. Journal of Hazardous Materials Advances 5
100052. https://doi.org/10.1016/j.hazadv.2022.100052
Fenech, M., Knasmueller, S., Bolognesi, C., Holland, N., Bonassi,
S., Kirsch-Volders, M. 2020. Micronuclei as biomarkers of DNA damage,
aneuploidy, inducers of chromosomal hypermutation and as sources of
pro-inflammatory DNA in humans. Mutation Research - Reviews in Mutation
Research 786 108342. https://doi.org/10.1016/j.mrrev.2020.108342
Ganapathy, S., Liu, J., Xiong, R., Yu, T., Makriyannis, A., Chen, C.
2018. Chronic low dose arsenic exposure preferentially perturbs mitotic phase
of the cell cycle. Genes and Cancer 10(1–2) 39–51. https://doi.org/10.18632/genesandcancer.185
GraphPad Software 2019. Prism 8.0 Software. Available from https://www.graphpad.com/scientific-software/prism/
Genchi, G.,
Sinicropi, M., Carocci, A., Lauria, G., Catalano, A. 2017. Mercury Exposure and Heart
Diseases. International Journal of Environmental Research and Public
Health 14(1) 74. https://doi.org/10.3390/ijerph14010074
Grant, W.F. 1994. The present status of higher plant bioassays for
the detection of environmental mutagens. Mutation Research/Fundamental
and Molecular Mechanisms of Mutagenesis 310(2)175–185. https://doi.org/10.1016/0027-5107(94)90112-0
Gutierres Moreno, L.C., Borja Acuña, R., Villa García, O., Troncoso Olivo,
W., Manjarrez García, G. 2011. Caracterización e impactos ambientales por
vertimientos en tramos de la cuenca media y baja del rio cesar,
valledupar. https://www.corpocesar.gov.co/riocesar.html
Harding, G.,
Dalziel, J., Vass, P. 2018. Bioaccumulation of methylmercury within the marine food web
of the outer Bay of Fundy, Gulf of Maine. PLOS ONE 13(7)
e0197220. https://doi.org/10.1371/journal.pone.0197220
Huang, H.-W., Lee, C.-H., Yu, H.-S. 2019. Arsenic-Induced
Carcinogenesis and Immune Dysregulation. International Journal of
Environmental Research and Public Health 16(15) 2746. https://doi.org/10.3390/ijerph16152746
Ibañez Solano, D.E., Angulo Reyes, M.R. 2022.
Evaluación del Riesgo Genotóxico de Aguas Superficiales y Sistemas de Riego
Mediante Estudios Ecotoxicológicos Empleando Células de Raices de Allium
cepa. Acta Nova 10(4), 430-442. https://www.scielo.org.bo/scielo.php?
script=sci_arttext&pid=S1683-07892022000200430&lng=es&tlng=es
Jomova, K.,
Jenisova, Z., Feszterova, M., Baros, S., Liska, J., Hudecova, D., Rhodes, C.J.,
et al. 2011. Arsenic:
toxicity, oxidative stress and human disease. Journal of Applied
Toxicology 31(2) 95–107. https://doi.org/10.1002/jat.1649
Kassa, B.A. 2021. Cytotoxicity and Genotoxicity evaluation of
municipal wastewater discharged into the head of Blue Nile River using the
Allium Cepa test. Scientific African 13 e00911. https://doi.org/10.1016/j.sciaf.2021.e00911
Kjelland, M.E., Woodley, C.M., Swannack, T.M., Smith, D.L. 2015. A
review of the potential effects of suspended sediment on fishes: potential
dredging-related physiological, behavioral, and transgenerational
implications. Environment Systems and Decisions 35(3) 334–350. https://doi.org/10.1007/s10669-015-9557-2
Kuo, C.-C., Balakrishnan, P., Gribble, M.O., Best, L.G., Goessler, W.,
Umans, J.G., Navas-Acien, A. 2022. The association of arsenic exposure and
arsenic metabolism with all-cause, cardiovascular and cancer mortality in the
Strong Heart Study. Environment International 159
107029. https://doi.org/10.1016/j.envint.2021.107029
Leme, D.M., Marin-Morales, M.A. 2009. Allium cepa test
in environmental monitoring: A review on its application. Mutation
Research/Reviews in Mutation Research 682(1) 71–81. https://doi.org/10.1016/j.mrrev.2009.06.002
León-Mejía, G., Rueda, R.A., Pérez, J., Miranda-Guevara, A., Moreno, O.F.,
Quintana-Sosa, M., Trindade, C., et al. 2023a. Analysis of the cytotoxic and genotoxic
effects in a population chronically exposed to coal mining residues. Environmental Science and Pollution
Research 30(18)
54095–54105. https://doi.org/10.1007/s11356-023-26136-9
León-Mejía, G.,
Vargas, J.E., Quintana-Sosa, M., Rueda, R.A., Pérez, J.P., Miranda-Guevara, A.,
Moreno, O.F., et al. 2023b. Exposure to coal mining can lead to imbalanced levels of
inorganic elements and DNA damage in individuals living near open-pit mining
sites. Environmental Research 227 115773. https://doi.org/10.1016/j.envres.2023.115773
Lin, L., Yang, H., Xu, X. 2022. Effects of Water Pollution on Human Health
and Disease Heterogeneity: A Review. Frontiers in Environmental Science 10. https://doi.org/10.3389/fenvs.2022.880246
Lu, Y., Song, S., Wang, R., Liu, Z., Meng, J.,
Sweetman, A.J., Jenkins, A., et al. 2015. Impacts of soil and water pollution
on food safety and health risks in China. Environment International 77 5–15. https://doi.org/10.1016/j.envint.2014.12.010
Ministerio de
Ambiente y Desarrollo Sostenible. 2018. Entra en vigencia prohibición del
mercurio en la minería de oro en Colombia. Ministerio de Ambiente y
Desarrollo Sostenible.
Miranda-Guevara, A., Muñoz-Acevedo, A., Fiorillo-Moreno, O., Acosta-Hoyos,
A., Pacheco-Londoño, L., Quintana-Sosa, M., De Moya, Y., et al. 2023. The dangerous link between coal
dust exposure and DNA damage: unraveling the role of some of the chemical
agents and oxidative stress. Environmental Geochemistry and Health 45(10)
7081–7097. https://doi.org/10.1007/s10653-023-01697-3
Muñoz, N.C., González-Álvarez, D., Jaramillo, A.C., Soto-Ospina,
A., Ruiz, Á.A. 2023. Toxicological risk in individuals exposed to methylmercury
and total mercury through daily-consumed foodstuffs in one of the mining
regions of Bajo Cauca, Antioquia, Colombia. Emerging Contaminants 9(2)
100226. https://doi.org/10.1016/j.emcon.2023.100226
Novo, J.P., Martins, B., Raposo, R.S., Pereira, F.C., Oriá, R.B.,
Malva, J.O., Fontes-Ribeiro, C. 2021. Cellular and Molecular Mechanisms
Mediating Methylmercury Neurotoxicity and Neuroinflammation. International
Journal of Molecular Sciences 22(6) 3101. https://doi.org/10.3390/ijms22063101
Nunes, E.A., de
Lemos, C.T., Gavronski, L., Moreira, T.N., Oliveira, N.C.D., da Silva, J. 2011.
Genotoxic
assessment on river water using different biological systems. Chemosphere 84(1)
47–53. https://doi.org/10.1016/j.chemosphere.2011.02.085
Oubane, M., Khadra, A., Ezzariai, A., Kouisni, L., Hafidi, M.
2021. Heavy metal accumulation and genotoxic effect of long-term
wastewater irrigated peri-urban agricultural soils in semiarid climate. Science
of The Total Environment 794 148611. https://doi.org/10.1016/j.scitotenv.2021.148611
Pathiratne, A., Hemachandra, C.K., De Silva, N. 2015. Efficacy of
Allium cepa test system for screening cytotoxicity and genotoxicity of
industrial effluents originated from different industrial activities. Environmental
Monitoring and Assessment 187(12) 730. https://doi.org/10.1007/s10661-015-4954-z
Pelcová, P., Kopp, R., Ridošková, A., Grmela, J., Štěrbová, D. 2022.
Evaluation of mercury bioavailability and phytoaccumulation by means of a DGT
technique and of submerged aquatic plants in an aquatic ecosystem situated in
the vicinity of a cinnabar mine. Chemosphere 288 132545. https://doi.org/10.1016/j.chemosphere.2021.132545
Quiroz-Arcentales, L., Hernández-Flórez, L.J., Agudelo Calderón, C.A., Medina,
K., Robledo-Martínez, R., Osorio-García, S.D. 2013. PM10 exposure-related respiratory symptoms
and disease in children living in and near five coal-mining areas in the Cesar
department of Colombia. Revista de Salud Pública (Bogotá, Colombia) 15(1) 66–79.
Rozo Castillo, L.M. 2021. ¿Zona de sacrificio? Impactos sociales y ambientales de la
industria petrolera en el municipio de Castilla la Nueva, Meta para el periodo
2000–2020. Tesis de grado. Universidad de los Andes. https://repositorio.uniandes.edu.co/server/api/core/
bitstreams/5b8e3c32-0806-4228-bcc0-42714a3b152f/content
Sabeen, M., Mahmood, Q., Ahmad Bhatti, Z., Faridullah, Irshad, M.,
Bilal, M., Hayat, M.T., et al.
2020. Allium cepa
assay based comparative study of selected vegetables and the chromosomal
aberrations due to heavy metal accumulation. Saudi Journal of
Biological Sciences 27(5) 1368–1374. https://doi.org/10.1016/j.sjbs.2019.12.011
Sidabutar, N.V.,
Namara, I., Hartono, D.M., Soesilo, T.E.B. 2017. The effect of anthropogenic activities to
the decrease of water quality. IOP Conference Series: Earth and
Environmental Science 67 012034. https://doi.org/10.1088/1755-1315/67/1/012034
Wijeyaratne, W.M.D.N., Wadasinghe, L.G.Y.J.G. 2019a.
Allium cepa Bio Assay to Assess the Water and Sediment Cytogenotoxicity in a
Tropical Stream Subjected to Multiple Point and Nonpoint Source
Pollutants. Journal of Toxicology 2019 1–10. https://doi.org/10.1155/2019/5420124
Wijeyaratne, W.M.D.N., Wadasinghe, L.G.Y.J.G. 2019b.
Allium cepa Bio Assay to Assess the Water and Sediment Cytogenotoxicity in a
Tropical Stream Subjected to Multiple Point and Nonpoint Source
Pollutants. Journal of Toxicology 2019 1–10. https://doi.org/10.1155/2019/5420124
Willcock, S., Cooper, G.S., Addy, J., Dearing, J.A. 2023. Earlier
collapse of Anthropocene ecosystems driven by multiple faster and noisier
drivers. Nature Sustainability 6(11) 1331–1342. https://doi.org/10.1038/s41893-023-01157-x
Wyatt, L.H., Luz, A.L., Cao, X., Maurer, L.L., Blawas, A.M.,
Aballay, A., Pan, W.K.Y., et al. 2017. Effects of methyl and inorganic mercury
exposure on genome homeostasis and mitochondrial function in Caenorhabditis
elegans. DNA Repair 52,31–48. https://doi.org/10.1016/j.dnarep.2017.02.005
![]() , Luz A. Castro-Camacho1,*, Karen Franco Valencia1
, Luz A. Castro-Camacho1,*, Karen Franco Valencia1 ![]() , Martha Ruiz-Benitez1
, Martha Ruiz-Benitez1 ![]() , Julian Rodríguez Tapia1
, Julian Rodríguez Tapia1 ![]() , Fredy Jose Torres Cantillo1
, Fredy Jose Torres Cantillo1 ![]()