Introducción
Los parásitos están presentes de forma ubicua en la
naturaleza y se han descrito efectos importantes en la evolución de las
poblaciones de hospedadores (Møller et al. 1993; Gandon y Michalakis 2002; Watson
2013). Sin embargo, el término “parásito” es utilizado para englobar un
conjunto de organismos que lo único que tienen en común es la evolución de una
estrategia vital: vivir a expensas de otro organismo. Dentro de la definición
de parásito cabe el que sus efectos reduzcan la eficacia biológica de sus
hospedadores. Sin embargo, este efecto no siempre es obvio debido, en parte, a
las historias coevolutivas entre parásitos y hospedadores que son dinámicas y
dependen de la estabilidad del ambiente. En ocasiones, se puede alcanzar un
equilibrio en la relación a través de procesos de coadaptación (Megía-Palma et al. 2018; 2023a;
2024). En este sentido, la teoría de las
estrategias vitales (Beilharz et al. 1993; Roff 2002) establece que ante ambientes cambiantes los
equilibrios coadaptativos pueden romperse en favor de los parásitos por los
costes de esos cambios ambientales sobre el comportamiento, u otras estrategias
antiparasitarias, de los hospedadores (Lafferty y
Kuris 1999; Megía-Palma et al. 2020; Horn y Luong 2021).
La reproducción supone un importante cambio fisiológico para
el hospedador del cual se puede beneficiar el parásito (French
et al. 2007; Van der Most et al. 2011; Knutie et al. 2017). De hecho, este “estrés” o esfuerzo
de reproducción se ha postulado recurrentemente como marco fisiológico en el
que poder explicar el incremento estacional de las prevalencias y/o de las
intensidades de algunos parásitos en las poblaciones de hospedadores como
consecuencia de la inmunodepresión sufrida por los hospedadores durante la
reproducción (Norris et al. 1994; Nordling et al. 1998; Saino et
al. 2000; French et al. 2007). Por ejemplo, en lagartijas postulamos que se puede
cuantificar el esfuerzo reproductor de una población mediante el análisis de la
variación fenológica en: (1) la expresión de la coloración nupcial de sus
individuos (entendiéndose aquella coloración que esté basada en pigmentos como
los carotenoides y pteridinas, y que sea reabsorbida tras el periodo de
emparejamiento); (2) el desarrollo gonadal (por ejemplo, el ancho del paquete
testicular); o (3) el estado de gravidez de las hembras, cuya inversión reproductora
entendemos como máxima durante la formación y acarreo de huevos. De este modo,
esperamos que las lagartijas tengan un mayor número de ectoparásitos durante
los periodos más demandantes de estos procesos. Sin embargo, podría ser que los
procesos subyacentes fuesen otros ya que no todos los parásitos funcionan igual
porque las historias coevolutivas de cada asociación parásito-hospedador
podrían ser tantas como poblaciones de hospedadores existen. Por ejemplo, la
variación fenológica en las intensidades de ciertos ectoparásitos en
poblaciones de lagartijas puede estar influida por condiciones
microclimáticas y la propia fenología de las poblaciones de ectoparásitos (Klukowski 2004; Pollock
y John-Alder 2020; Drechsler et al. 2021; Rivera-Rea et al. 2022).
Hemos investigado dos especies de lagartija pertenecientes a
la familia Lacertidae (Squamata) que no realizan ni cuidado de la puesta ni
cuidados parentales tras la eclosión de los huevos. Las dos especies tienen
tamaño similar, pero difieren en su selección de microambientes, así como en su
comportamiento de termorregulación (Belliure et al.
1996). Acanthodactylus erythrurus (Schinz 1833) pertenece a un
género de lacértidos con origen norteafricano (Tamar et
al. 2016) y ocupa suelos arenosos sueltos en espacios abiertos (Belliure 2015). Dedica la mayor parte del tiempo a
asolearse y mantiene temperaturas corporales significativamente más altas que
la segunda especie estudiada (Belliure et al. 1996).
Esta última, Psammodromus algirus (Linnaeus 1758), es una especie con
origen filogeográfico en la península ibérica (Carranza
et al. 2006) y que, aunque se le considera una generalista de hábitat,
ocupa preferentemente sotobosques con hojarasca y dedica gran parte de su
actividad diaria a desplazarse en busca de recursos (Carrascal
et al. 1989; Belliure et al. 1996). La máxima
actividad gonadal en ambas especies tiene lugar entre abril y mayo (Castilla et al. 1992; Díaz et
al. 1994). Esta época es de interés porque podría estar relacionada con una
mayor actividad de las lagartijas y un incremento de la susceptibilidad a
infección por ácaros (Barrientos y
Megía-Palma 2021), una vez que sabemos que ambas especies presentan ácaros
hematófagos en el área de estudio investigada (Megía-Palma
et al. 2022a; De los Ríos-Solera et al. 2024).
En el presente estudio vamos a comprobar si los patrones
fenológicos de reproducción pueden contribuir a explicar la variación observada
en el número de ácaros que tienen las lagartijas, en consonancia con la
hipótesis que postula que el esfuerzo de reproducción de las lagartijas
(cuantificado aquí con el ancho testicular y la variación en la expresión de la
coloración nupcial en los machos, y con el estado de gravidez en las hembras)
está relacionado con un aumento de las cargas de ectoparásitos. Esperamos que
las hembras grávidas tengan más ácaros que las no grávidas (como consecuencia
de los costes energéticos derivados de la producción de las puestas) en ambas
especies y que las hembras tengan menos ácaros que los machos en ambas especies
porque los machos de lagartija utilizan áreas de campeo más grandes que las
hembras (Perry y Garland 2002). Este hecho está
relacionado con la búsqueda de parejas por parte de los machos, así como con el
comportamiento de patrullaje para excluir a posibles machos competidores. En
este sentido, también esperamos que A. erythrurus tenga menos ácaros que
P. algirus porque en la zona de estudio la primera selecciona
microhábitats más secos, lo cual reduce la presencia de ácaros (Wu et al. 2019; BeVier et al. 2022),
y porque su patrón diario de actividad implica un menor número de
desplazamientos que en P. algirus (Belliure et
al. 1996). También describimos el patrón fenológico de la variación en la
complejidad cromática de la coloración nupcial de los machos de P. algirus y
esperamos poder mostrar una correlación entre el número de ácaros y la
fenología de la coloración (en P. algirus) y del ancho testicular (en A.
erythrurus). De cumplirse estas relaciones, los resultados se alinearían
con la predicción general que asume un incremento de la susceptibilidad a la
infestación por ectoparásitos en lagartijas debido a los costes asociados con
el esfuerzo de reproducción. Este trabajo aporta información novedosa sobre la
fenología de la reproducción de dos especies en un contexto mesomediterráneo a
la vez que analiza la variación en la presión por ectoparásitos que sufre esta
población y puede generar un conocimiento base para futuros estudios más
específicos.
Material y Métodos
Área de estudio y sistema de muestreo
En la segunda semana de cada mes, desde abril hasta
septiembre de 2022, se capturaron un total de 69 A. erythrurus (41
hembras y 28 machos) y 151 P. algirus (76 hembras y 75 machos) en un
bosque dominado por encinas (Quercus ilex) y con sotobosque de jara
pringosa (Cistus ladanifer) en el Monte de El Pardo (Madrid, España;
40.50°N, 3.76°W; ~ 680 msnm). Para ello se buscaron lagartijas de manera
aleatoria durante 2-3 días seguidos durante la tercera semana de cada mes en
días soleados. Se utilizó un lazo corredizo sujeto en el extremo de una vara de
1.5 m de longitud y que estaba hecho con seda de suturar heridas. Este hilo
cierra suave, pero firmemente, alrededor del cuello de las lagartijas al
capturarlas (Barrientos y Megía-Palma 2021).
Todos los datos fueron recolectados en el campo, y las lagartijas fueron
liberadas unos minutos después de su captura en el mismo punto de captura para
minimizar costes asociados (Barrientos y
Megía-Palma 2021). Los individuos fueron marcados con un punto blanco en el
dorso, utilizando para ello una pintura libre de xileno (e.g., Megía-Palma et al. 2022a). Los datos aquí
presentados incluyen un 5% de lagartijas que fueron capturadas más de una vez y
siempre en meses distintos. Sólo aquellos individuos considerados adultos
fueron incluidos en el muestreo. Esto se decidió basándonos en la longitud
desde la punta del hocico hasta la apertura cloacal (LHC) que medimos con una
regla transparente con precisión de 1 mm. Los individuos con menor LHC
incluidos en el análisis fueron considerados adultos porque, o bien presentaban
coloración nupcial en el caso de los machos de P. algirus (mínima talla
para un macho = 58 mm), o tenían claramente desarrollado el paquete testicular
y tenían coloración dorsolateral de adulto en el caso de los machos de A.
erythrurus (mínima talla para un macho = 65 mm). En el caso de las hembras,
el tamaño menor que se consideró fue aquel que tuvo la hembra más pequeña que
encontramos con huevos en el vientre (es decir, 60 mm en el caso de P.
algirus y 58 mm en el caso de A. erythrurus).
Inversión reproductora
En el caso de las hembras, un mismo investigador (R.M.-P.)
fue siempre el responsable de palpar su vientre para evaluar la presencia de
huevos y asignar el estado de grávida o no grávida. En el caso de los machos,
se hicieron fotografías de todos los individuos con un móvil (iPhone 8, Apple,
CA, EEUU). Se fotografió ventralmente a los machos de A. erythrurus
apoyando una regla (con precisión de 1 mm) sobre el paquete testicular porque
el ancho testicular varía a lo largo de los meses asociado al estado reproductor
(Castilla et al. 1992). Para los machos de P.
algirus, se fotografió con el mismo móvil el lateral de la cabeza y la
garganta porque la extensión y composición cromática de la coloración nupcial
se reduce una vez terminada la reproducción (Megía-Palma
et al. 2022b). Estas fotografías fueron luego utilizadas para medir el
ancho testicular en A. erythrurus (en mm) y clasificar a los machos de P.
algirus en seis categorías de acuerdo con la extensión de su coloración
naranja y amarilla (que es la basada en carotenoides y pteridinas en los machos
de esta población; Megía-Palma et al. 2021)
siguiendo el método propuesto por Díaz (1993) (Megía-Palma et al. 2022b). Dicha extensión fue
siempre categorizada visualmente por la misma persona (C.M.).
Conteos de ectoparásitos
En el campo, el mismo investigador (R.M.-P.) utilizó una
lupa con 10 aumentos para estimar el número total de ácaros (intensidad de
infestación). Estos se observaron principalmente entre las escamas de la cola y
el vientre de ambas especies de lagartija, aunque también pueden encontrarse en
otras zonas del cuerpo como por ejemplo los tímpanos, las axilas de las cuatro
extremidades y la base de la cola (Megía-Palma et
al. 2022a; 2022b; De los Ríos-Solera et al. 2024).
Análisis estadísticos
Realizamos los análisis estadísticos en Statistica 12.0
(StatSoft, Hamburgo, Alemania). Para comparar la prevalencia de ácaros entre
especies, utilizamos una prueba de Chi-cuadrado. Para los conteos de ácaros
(intensidad de infestación), los cuatro modelos realizados se ajustaron mejor
con una distribución Gaussiana de los residuos tras transformar los datos de
ácaros mediante logaritmo decimal que sin transformar. Por tanto, la intensidad
de infestación transformada logarítmicamente se usó como variable dependiente
en todos los modelos. En el primer modelo, que analizó el total de los
individuos (N = 220), se incluyeron como predictores los factores mes, especie
y sexo de las lagartijas. Además, se incluyeron las interacciones entre el mes
y el sexo, el mes y la especie, y el sexo y la especie.
Se realizaron tres modelos
más para analizar la variación en la intensidad de infestación en relación con
los indicadores de inversión en reproducción utilizados. En el caso de las
hembras, se pudieron analizar los datos de ambas especies juntos (n = 117) por
ser el estado de gravidez el indicador utilizado. Se controló el modelo por los
factores mes, especie y estado de gravidez. Se incluyó la interacción entre el
estado de gravidez y la especie, para comprobar si el número de ácaros se ve
influido de manera diferente, en función de la especie, por el estado de
gravidez. La LHC se incluyó como posible variable confundidora (Drechsler et al. 2021).
En el caso de los machos de A. erythrurus (n = 28),
los ácaros se modelaron incluyendo el mes como factor y el ancho testicular
como predictor lineal. En el caso de los machos de P. algirus (n = 75),
los ácaros se modelaron incluyendo también el mes como factor y el grupo de
extensión de la coloración nupcial en el que fueron asignados como predictor
categórico.
Resultados
La LHC media (± el error estándar) de las hembras de A.
erythrurus fue de 70.46 ± 0.78 mm (rango = 58-82 mm); en los machos de esta
especie fue 74.25 ± 0.79 mm (65-82 mm). En el caso de las hembras de P.
algirus, la LHC fue de 68.65 ± 0.60 mm (60-78 mm) y en los machos de 70.13
± 0.60 mm (58-80 mm).
Fenología de la inversión en reproducción
Hembras
La variación mensual en la frecuencia de aparición de
hembras grávidas en la población indicó que P. algirus presenta dos
eventos de reproducción mientras que A. erythrurus sólo uno (Fig. 1).
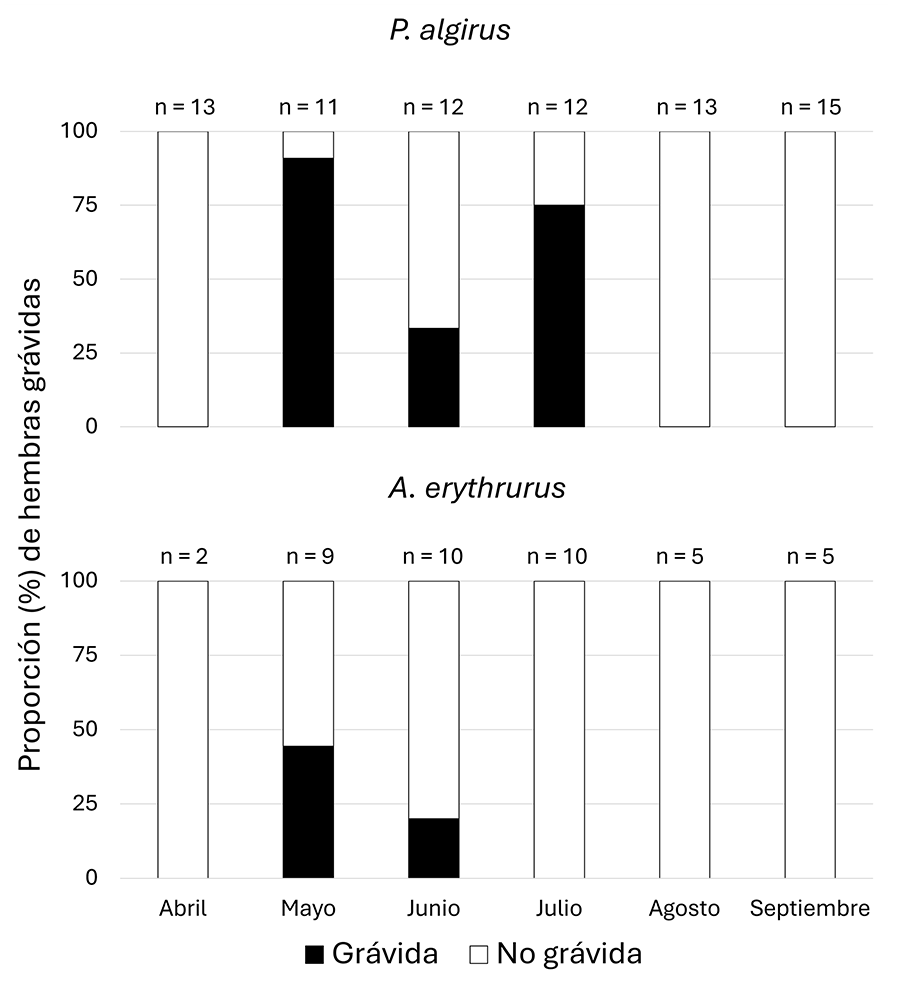
Figura 1. Variación mensual en la frecuencia de
hembras grávidas de las dos especies de estudio en el Monte de El Pardo. El
tamaño muestral para cada especie y mes se muestra encima de las barras.
Figure 1.
Monthly variation in the frequency of gravid females of the two study species
in Monte de El Pardo. The sample size for each species and month is shown above
the bars.
Machos
Para el caso de P. algirus se observó en la población
una mayor representatividad de grupos cromáticos con mayor superficie
pigmentada (grupos verde, violeta y rojo; Fig. 2a)
en los meses de abril a junio, coincidiendo con el periodo de emparejamiento de
esta especie. También se observó una mayor preponderancia del grupo cromático
de menor pigmentación (grupo amarillo; Fig. 2a)
en los meses de junio a septiembre, donde la diversidad cromática en la
población de machos de esta especie se redujo a la presencia solamente de
machos asignados a los dos grupos de menor extensión de pigmentación (Fig. 2b).
En el caso de A. erythrurus, se observó que el máximo
ancho testicular en los machos ocurrió en los meses de mayo y junio, con un
descenso de éste en los siguientes meses (Fig. 2c
y Fig. 2d).
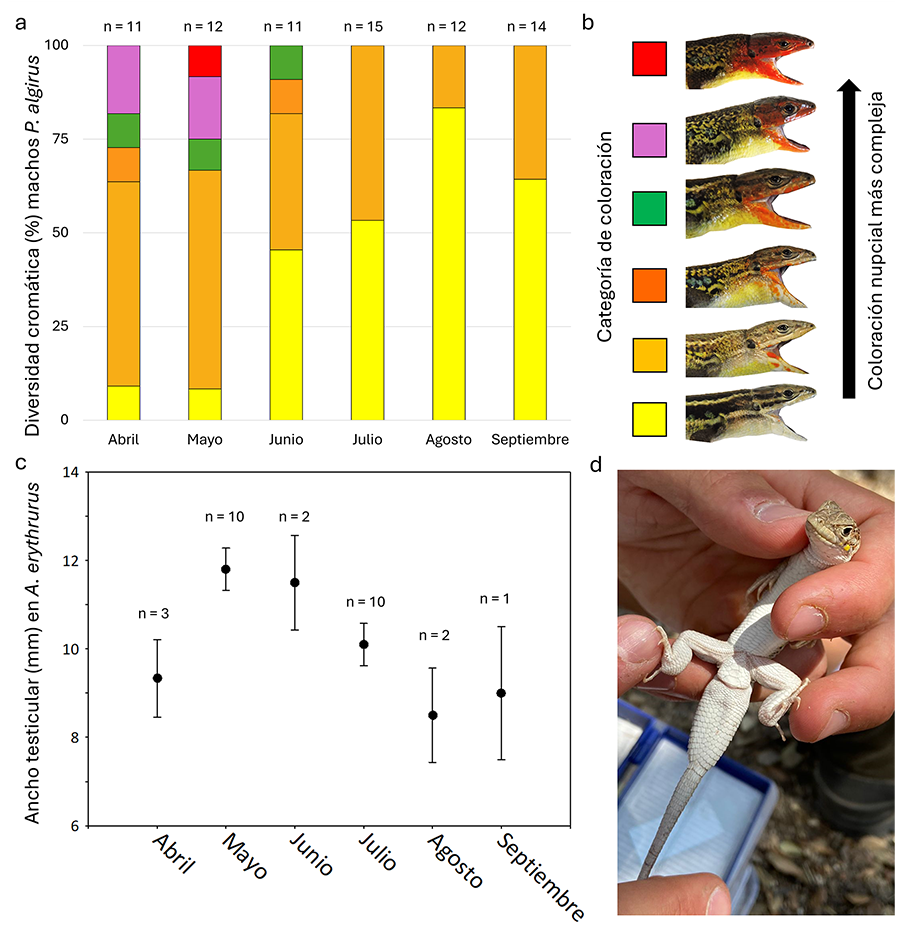
Figura 2. (a) Variación de abril a septiembre
de 2022 en la frecuencia de machos de lagartija colilarga (P. algirus)
categorizados en seis grupos (siguiendo Díaz 1993) en
función de la superficie de pigmentación de su coloración nupcial en el Monte
de El Pardo (Madrid). El tamaño muestral para cada especie y mes se muestra
encima de las barras. (b) Los códigos de colores usados en (a)
corresponden, de abajo hacia arriba, a lagartijas con mayor superficie
pigmentada. (c) Media ± error estándar mensual del ancho del paquete
testicular en los machos de A. erythrurus en la población del Monte de
El Pardo. (d) Fotografía ventral de un macho de A. erythrurus capturado
en junio mostrando el paquete testicular.
Figure 2. (a) Frequency variation of male nuptial coloration categories
(following Díaz 1993) in P. algirus observed
from April to September 2022 in Monte de El Pardo (Madrid). The sample size for
each species and month is shown above the bars. (b) The color codes used
in (a) correspond, from bottom to top, to lizards with a larger pigmented
surface. (c) Monthly mean ± standard error of the width of the testes in
A. erythrurus males in the Monte de El Pardo population. (d)
Ventral photograph of a male A. erythrurus captured in June showing the
testes.
Ectoparásitos
Encontramos ácaros entre las
escamas de ambas especies de lagartija, y pese a la presencia relativamente
abundante de garrapatas en el área de estudio (observación personal), no
encontramos ninguna sobre las lagartijas. La prevalencia de ácaros fue diferente
para ambas especies (χ21, 219 = 25.69, P <
0.001), con el 62.3% de A. erythrurus infestados (hembras = 63.4% y
machos = 60.7%) y el 90.7% de los P. algirus (hembras = 89.5% y machos =
92.0%). La intensidad de infestación fue significativamente menor en A.
erythrurus que en P. algirus con una tendencia no significativa a
que los machos de ambas especies presentaran intensidades mayores (Tabla 1). Las hembras de A. erythrurus
tuvieron una abundancia promedio de 4.75 ± 1.24 (0-39) ácaros frente a los
15.07 ± 6.93 (0-178) de los machos. Las hembras de P. algirus tuvieron
12.64 ± 1.57 (0-65) ácaros frente a los 25.81 ± 3.98 (0-250) de los machos. Los
resultados del modelo indicaron que fueron significativos los efectos de las
interacciones de la especie con el mes y del sexo con el mes (Tabla
1). Vimos que A. erythrurus mantuvo intensidades de parasitación
por ácaros similares durante todo el periodo de actividad y en general menores
que P. algirus. Esta segunda especie mostró una tendencia al alza en el
número de ácaros de abril a julio y después la intensidad de infestación
descendió hasta septiembre (Fig. 3a). Mientras
tanto, los machos tuvieron particularmente más ácaros que las hembras durante
el mes de mayo (Fig. 3b).
Tabla 1. Modelo
lineal general analizando el número de ácaros (transformado mediante log10)
en todas las lagartijas (N = 220). SC = suma de cuadrados; gl = grados de
libertad. Mes corresponde al periodo de abril a septiembre de 2022. Los efectos
significativos (α = 0.05) están marcados en negrita.
Table 1. General linear
model analyzing the number of mites (log10 transformed) on all
lizards (N = 220). SC = sum of squares; df = degrees of
freedom. Month corresponds to the period from April to September 2022.
Significant effects (α = 0.05) are marked in bold.
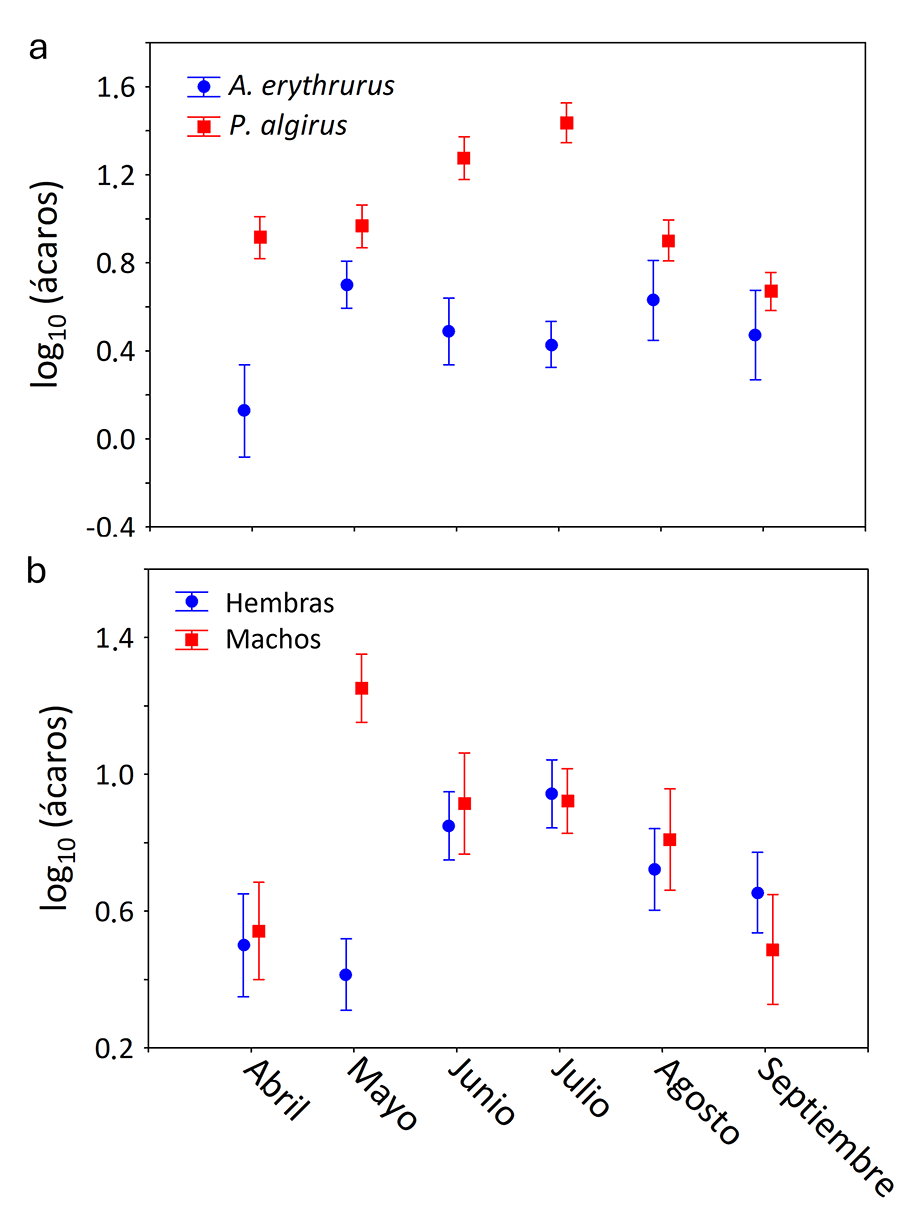
Figura 3. Representación de las interacciones
significativas mostradas en la Tabla 1.
(a) Variación fenológica del número de ácaros hematófagos sobre A.
erythrurus y P. algirus. (b) Variación fenológica del número
de ácaros atendiendo al sexo de las lagartijas.
Figure 3.
Significant interactions shown in Table 1. (a)
Phenological variation in the number of hematophagous mites on A. erythrurus
and P. algirus. (b) Phenological variation in the number of mites
according to the sex of the lizards.
Parasitación e inversión reproductora
El estado de gravidez influyó de manera significativamente
diferente en la intensidad de parasitación por ácaros en función de la especie
(Tabla 2). En este sentido, las hembras no
grávidas de A. erythrurus tuvieron significativamente menos ácaros (3.94
± 1.24) que las hembras grávidas de esta especie (9.50 ± 4.25 ácaros) y que
cualquier hembra de P. algirus (no grávidas = 11.85 ± 1.72; grávidas =
14.48 ± 3.40) (Fig. 4).
Tabla 2. Modelo
lineal general analizando el número de ácaros (transformado mediante log10)
en las hembras (n = 117) de A. erythrurus y P. algirus. SC = suma
de cuadrados; gl = grados de libertad. Mes corresponde al periodo de abril a
septiembre de 2022. Estado de gravidez = con huevos en el vientre detectados
mediante palpado. Los efectos significativos (α = 0.05) están marcados en
negrita.
Table 2. General linear
model analyzing the number of mites (log10 transformed) on females
(n = 117) of A. erythrurus and P. algirus. SC =
sum of squares; df = degrees of freedom. Month corresponds to the period from
April to September 2022. Gravidity = with eggs on the belly detected by
palpation. Significant effects (α = 0.05) are marked in bold.
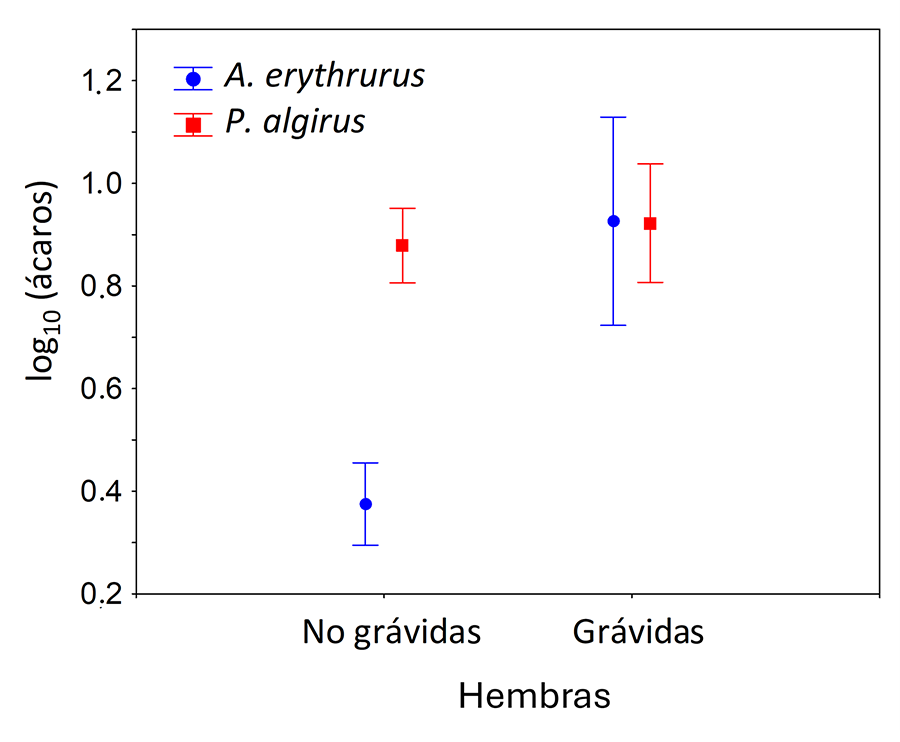
Figura 4. Media ± error estándar del número de
ácaros presentes sobre las hembras de A. erythrurus y P. algirus
atendiendo a su estado de gravidez resultado del modelo presentado en la Tabla 2.
Figure 4.
Mean ± standard error of the number of mites found on the females of A.
erythrurus and P. algirus according to their gravidity status (model
presented in Table 2).
De nuevo, la variación en los
machos de la intensidad de infestación por ácaros fue explicada
significativamente por el factor mes, pero sólo en el caso de P. algirus
(Tabla 3). Ni el ancho del paquete testicular en
el caso de A. erythrurus, ni la extensión de la coloración nupcial en el
caso de P. algirus, explicaron la variación en el número de ácaros que
tenían los machos de lagartija (Tabla 3). Las
tendencias gráficas, no significativas, entre la intensidad de infestación y
las variables utilizadas para cuantificar el esfuerzo reproductor de los machos
se pueden ver en material suplementario (Fig. S1a
y Fig. S1b).
Tabla 3. Dos modelos
lineales generales que analizan el número de ácaros (transformado mediante log10)
de forma independiente para los machos de A. erythrurus (n = 28) y P.
algirus (n = 75). SC = suma de cuadrados; gl = grados de libertad. Mes
corresponde al periodo de abril a septiembre de 2022. Los efectos
significativos (α = 0.05) están marcados en negrita.
Table 3. Two general linear models analyzing mite
numbers (log10 transformed) independently for males of A.
erythrurus (n = 28) and P. algirus (n = 75). SC =
sum of squares; df = degrees of freedom. Month corresponds to the period from
April to September 2022. Significant effects (α = 0.05) are marked in bold.
Discusión
Los resultados de inversión en reproducción fueron
comparables en el caso de las hembras porque en ambas especies utilizamos el
estado de gravidez como aproximación. Los patrones fenológicos en el estado de
gravidez mostraron que la estrategia de reproducción difiere entre ambas
especies pese a que todas las lagartijas fueron capturadas en la misma área de
estudio. Así, P. algirus tiene dos eventos de reproducción en esta
localidad, como ya habían indicado Iraeta et al. (2007),
mientras que sólo se observó un evento de reproducción en A. erythrurus.
Esta diferencia la podemos interpretar como un efecto de la calidad del hábitat
con respecto a las necesidades de cada especie. Es decir, podemos esperar que
las lagartijas produzcan más de una puesta en aquellos hábitats más favorables
(Warner et al. 2007), como de hecho es más frecuente
que ocurra en poblaciones de P. algirus que no estén en el límite de su
distribución (Salvador 2015). Por tanto, esto sugiere
que el Monte de El Pardo es en la actualidad un hábitat que ofrece mejor
calidad ambiental para P. algirus y es subóptimo para A. erythrurus.
No obstante, también se han descrito efectos climáticos anuales sobre la
probabilidad de que tengan lugar segundas puestas en otras poblaciones de A.
erythrurus del centro peninsular, al menos en cierta proporción de las
hembras (Castilla et al. 1992). En este sentido, A.
erythrurus es una especie más termófila que P. algirus (Carretero y Llorente 1995) y se entiende que
un año climáticamente propicio para la primera especie podría ser aquel donde
la temperatura aumentara durante los primeros meses tras el descanso invernal.
Precisamente el año 2022 presentó eventos de olas de calor en abril y mayo, y
pese al ambiente térmico presuntamente más propicio para la especie más
termófila, ésta mostró un solo evento de reproducción. Nuestra interpretación
de que el Monte de El Pardo ofrece mejores condiciones ambientales para P.
algirus también está apoyada por la diferencia de abundancia frente a A.
erythrurus, habiendo sido la primera especie capturada 2.18 veces más
frecuentemente, pese a que se realizó un esfuerzo similar en la búsqueda de
ambas. Este hecho está posiblemente explicado por la diferente disponibilidad
de microhábitats elegidos por cada especie (observación personal). A.
erythrurus además de ser una especie más termófila, también selecciona
medios abiertos con suelos arenosos sueltos (Carretero
y Llorente 1995; Belliure 2015; Drechsler et al. 2021), mientras que P. algirus,
aunque de hábitos considerados generalistas, tiene una mayor preferencia por
sotobosques con hojarasca (Carrascal et al. 1989),
microhábitat este último que representa aproximadamente el 80% en el área de
estudio.
Es llamativo que en agosto no se encontrase ninguna hembra
grávida después de que en julio se encontró una proporción de hembras grávidas
similar a las encontradas en mayo, y sin embargo en junio sí se observara
cierta proporción de hembras grávidas. Esto plantea tres escenarios
alternativos: (i) o bien las hembras de P. algirus son muy eficientes
depositando los huevos en las segundas puestas y no dio tiempo a encontrar ya
hembras grávidas en agosto que hubieran comenzado con el desarrollo de los
huevos el mes anterior, o bien (ii) debido a las olas de calor sufridas en
2022, siendo las temperaturas más altas de todo el periodo las registradas en
julio (datos no mostrados), se hubieran producido fenómenos de reabsorción
folicular (Blackburn 1998); en un escenario más
pesimista también podría haber ocurrido (iii) que las hembras que estuvieran
realizando una mayor inversión reproductora con una segunda puesta murieran
ante las condiciones climáticas extremadamente adversas de sequía y calor durante
las olas de calor de julio de 2022 (Wang et al. 2016; Dupoué et al. 2020). La naturaleza observacional de
nuestros datos no permite sacar conclusiones.
Las aproximaciones para cuantificar la inversión en
reproducción utilizadas no fueron comparables para el caso de los machos de
ambas especies porque en P. algirus utilizamos la extensión de la
coloración nupcial, mientras que en A. erythrurus utilizamos la
variación en el ancho del paquete testicular. No obstante, los resultados de
las curvas mensuales para cada especie sí sugirieron una variación fenológica
en la inversión en reproducción. En P. algirus la frecuencia de machos
clasificados en los grupos de coloración nupcial más extensa fue mayor en los
meses de abril a junio. Es interesante el hecho de que abril sea el mes
descrito con la mayor actividad gonadal en los machos del centro peninsular (Díaz et al. 1994), lo que sugiere que aunque la
producción y mantenimiento de la coloración nupcial está influida por las
reservas energéticas con las que emerjan del descanso invernal (Megía-Palma et al. 2022b), también hay
probablemente un efecto hormonal que activa la producción de la coloración
nupcial durante el primer mes de actividad de las lagartijas (Salvador et al. 1996). Comparando visualmente las
curvas fenológicas de coloración nupcial y estado de gravidez de P. algirus se
puede interpretar que los machos realizan un mayor esfuerzo en mantener
pigmentos en la piel destinados a producir la coloración nupcial, con la que
atraen a las hembras y señalizan su agresividad y reducen conflictos con otros
machos, durante el periodo en el que las hembras están receptivas (de abril a
junio). Y en los meses siguientes, cuando las hembras están ya formando huevos,
los pigmentos son posiblemente redistribuidos a otras funciones sistémicas que
permiten a las lagartijas no ser tan visibles para los depredadores (Díaz 1993; Smolinský et al. 2022),
a la vez que posiblemente favorecen su estado de salud general y el sobrevivir
otro año debido al presunto papel como antioxidantes de los carotenoides y
pterinas que componen su coloración nupcial (Svensson
y Wong 2011; Megía-Palma et al. 2021).
En el caso de los machos de A. erythrurus, la curva
fenológica del ancho del paquete testicular sugiere que el máximo de actividad
gonadal comenzó más tarde que para P. algirus, concretamente en mayo, y
se prolongó durante junio, probablemente debido a que la temperatura era más
cálida que en abril. Esta especie, como hemos indicado, es más termófila y
estaba más activa a partir de mayo. Es interesante que, pese a que la actividad
de A. erythrurus empieza más tarde, la mayor frecuencia de hembras
grávidas ocurrió simultáneamente en ambas especies. Este ajuste fenológico
podría ser un modo de sincronizar los nacimientos en ambas especies y así
diluir la presión de depredación en general (i.e., estrategia del saciado)
al haber neonatos de las dos especies disponibles al mismo tiempo. También
podría estar relacionado con una reducción en la competencia de los juveniles
de P. algirus sobre los neonatos de A. erythrurus, si los
primeros fueran de mayor tamaño al haber nacido antes (Rasmussen
et al. 2014). El mecanismo por el cual pudiera ocurrir esto abre preguntas
interesantes para futuros estudios. Por ejemplo, sería poco probable que las
hembras de A. erythrurus almacenaran y utilizaran el esperma de los
machos con los que copularon el año anterior para fertilizar los folículos
antes de que comenzara la actividad reproductora de los machos del año en curso
(Rafferty y Reina 2012), y con ello conseguir
depositar huevos a la vez que P. algirus pese a que esta última empieza
antes su actividad reproductora, porque la esperanza de vida de A.
erythrurus es de una única temporada reproductora (Busack y Jaksic 1982; Drechsler y Monrós 2019). Alternativamente, se
ha descrito que las hembras de A. erythrurus tardan tan sólo 20 días
tras la cópula en hacer la puesta (Belliure 2015)
mientras que P. algirus tarda entre 30 y 40 días (Salvador
2015), lo que posibilitaría el solapamiento en el periodo de puestas.
Planteamos la posibilidad de que el desarrollo aparentemente más rápido de los
huevos en A. erythrurus esté facilitado por un metabolismo rápido debido
a que la temperatura corporal en el campo de A. erythrurus en esta
población es, en promedio, 3.43 ºC mayor que la de P. algirus (Blázquez-Castro,
datos sin publicar).
Pese a las diferencias en la fenología del esfuerzo de
reproducción mostrado por los machos de ambas especies, no hubo efecto
significativo de la especie en la fenología de la variación en la intensidad de
infestación por ácaros, siendo para ambas especies de lagartija el número de
ácaros mayor en mayo para los machos que para las hembras. Esto podría estar
relacionado con el hecho de que mayo es, en la población de estudio, un mes de
alta actividad de búsqueda de pareja y competición entre los machos para reproducirse,
con los desplazamientos asociados; una mayor movilidad de las lagartijas se
puede relacionar con una mayor exposición a los ácaros en esta población (Barrientos y Megía-Palma et al. 2021).
También mayo, pese a las olas de calor sufridas durante este mes, fue
relativamente húmedo gracias a algunas lluvias locales esporádicas (datos no
mostrados) que podría contribuir a explicar una mayor presión por ácaros en la
población estudiada (Rivera-Rea et al. 2022).
Las variables utilizadas como aproximación a la inversión en
reproducción de las lagartijas sólo explicaron la variación observada en las
intensidades de infestación por ácaros en el caso de las hembras, ya que las
hembras no grávidas de A. erythrurus tenían un menor número de ácaros
que aquellas que estaban formando huevos, siendo este patrón coincidente con
las hembras grávidas de A. erythrurus en un estudio anterior en el este
peninsular (Drechsler et al. 2021). Además, estas
hembras grávidas tuvieron cargas de ácaros similares a las hembras de P.
algirus. Como se ha explicado anteriormente, existen varios estudios que
muestran que los ectoparásitos, y en particular los ácaros, pueden aumentar en
las lagartijas en función de la mayor humedad de los microhábitats ocupados por
éstas (BeVier et al. 2022), porque los ácaros son más
abundantes en sustratos cálidos y húmedos (Wu et al. 2019).
Además, los ácaros aumentan en la población de estudio en aquellas lagartijas
que se desplazan distancias más largas (Barrientos
y Megía-Palma 2021). En relación con esto, el aumento en la actividad de
termorregulación cuando los ambientes térmicos se vuelven más restrictivos
hacia el verano y las lagartijas se mueven más entre microambientes térmicos
que posibiliten el mantenimiento de su temperatura corporal dentro de márgenes
fisiológicos operativos también aumenta la carga de ácaros (Megía-Palma et al. 2022a). En este sentido, los
resultados concordarían con estudios previos que demuestran que las hembras de
lagartija incrementan su preferencia por ocupar microhábitats calientes y
húmedos cuando están grávidas (Li et al. 2018). Estos
microhábitats son propicios para los ácaros (Wu et al. 2019;
BeVier et al. 2022) y la presunta mayor exposición a
ácaros hematófagos en las hembras grávidas de A. erythrurus
representaría un coste añadido a la inversión reproductora ya que estos
artrópodos, además de extraer sangre, son potenciales vectores de patógenos y
parásitos sanguíneos (Megía-Palma et al. 2023b).
Cabe puntualizar que los datos obtenidos en este trabajo no son válidos para
demostrar que las hembras grávidas prefieran microhábitats calientes y húmedos.
Del mismo modo, la mayor prevalencia e intensidad generales de infestación por
ácaros en P. algirus se puede explicar porque esta especie selecciona
microhábitats con hojarasca y, por lo general, más húmedos que los
seleccionados por A. erythrurus, y los ácaros son más abundantes sobre
las lagartijas en este tipo de substratos, como muestra un trabajo que estudió
las cargas de ácaros en lagartijas en un ecotono duna-pinar en el este
peninsular (Drechsler et al. 2021). Además de las
diferencias en las preferencias de microhábitats, el trabajo de Belliure et al. (1996), que comparó el
comportamiento de termorregulación y las estrategias de búsqueda de alimento de
A. erythrurus y P. algirus, mostró que la primera especie
permanece, de forma general, una gran proporción del tiempo asoleándose en
medios abiertos y con poca actividad de desplazamiento, lo cual podría reducir
su exposición a los ectoparásitos. Mientras tanto, además de la ya mencionada
preferencia por sotobosques con hojarasca de P. algirus, ésta dedica
una elevada proporción del tiempo a moverse para buscar presas activamente (Belliure et al. 1996) y al desplazarse puede
incrementar su exposición a los ácaros (Barrientos
y Megía-Palma 2021; Megía-Palma et al. 2022a).
Como explicación complementaria, también es posible que la mayor abundancia de P.
algirus en el área de estudio contribuya a una mayor tasa de transmisión de
ectoparásitos, y por ende una mayor prevalencia.
Nuestro trabajo no apoya conclusiones derivadas de estudios
anteriores en los que se interpretaron efectos directos del esfuerzo de
reproducción (mediado por un incremento de la actividad gonadal, y reflejado en
la producción de puestas en las hembras y un mayor desarrollo de la coloración
nupcial en los machos) aumentando la susceptibilidad a los ectoparásitos en
lagartijas. Es más, en el caso de los machos de P. algirus la tendencia
gráfica (no significativa) es negativa cuando se comparó el número de ácaros
con la extensión de la coloración nupcial (Fig. S1b).
Esta tendencia no significativa, sin embargo, está más en consonancia con
aquellos estudios que sugieren una relación positiva entre la distancia
recorrida por las lagartijas y el uso compartido de microambientes propicios
para los ácaros, con la consiguiente sobreexposición a estos parásitos en ambos
casos (Olsson et al. 2000; Wu et
al. 2019; Wieczorek et al. 2020; Barrientos y Megía-Palma 2021; Megía-Palma et al. 2022a; BeVier
et al. 2022). De hecho, en un trabajo previo con machos de esta población, Megía-Palma et al. (2022b) encontraron que los
machos con menor extensión de coloración nupcial recorrieron distancias
lineales más largas que los machos con mayor superficie coloreada. Por lo
tanto, la mayor movilidad de los machos adultos de P. algirus, jóvenes o
de peor calidad (Martín y Forsman 1999), y
que expresan de forma incompleta su coloración nupcial, podría favorecer la
frecuencia con la que se encuentran con ácaros (Barrientos y Megía-Palma 2021), por
ejemplo, al desplazarse entre territorios de los machos de mejor calidad (Salvador et al. 1995). Por lo tanto, todos nuestros
resultados sugieren una relación positiva entre el incremento en la actividad
motora durante los primeros meses de actividad tras la hibernación y la
exposición a ácaros hematófagos en P. algirus, posiblemente asociada con
el incremento del número de movimientos entre microhábitats térmicos en los que
las lagartijas termorregulan, y no necesariamente relacionado con la
reproducción (Megía-Palma et al. 2022a). El
posterior descenso observado del número de ácaros en agosto en P. algirus
podría deberse a que el ambiente es demasiado seco para los ácaros en ese mes
al tiempo que las lagartijas en esta localidad se desplazan poca distancia al
permanecer dentro de los arbustos a la sombra (Díaz et al.
2022). No obstante, en general, los trabajos previos sí apoyan que la
testosterona puede incrementar el número de ectoparásitos en las lagartijas (Olsson et al. 2000; Klukowski
y Nelson 2001; Roberts et al. 2004; Cox y John-Alder 2007), aunque algunos trabajos
muestran efectos contradictorios en relación con los ácaros (Pollock et al. 2012; Argaez et
al. 2021). Por ejemplo, aquellas lagartijas que durante su fase embrionaria
estuvieron expuestas a mayores concentraciones de testosterona no mostraron
posteriormente ni recuentos leucocitarios menores ni un mayor número de ácaros
(Uller y Olsson 2003). Sin embargo, son sólidos
los resultados que muestran que la testosterona sí puede incrementar la
actividad motora en lagartijas (Marler y Moore 1989;
Olsson et al. 2000; Klukowski
et al. 2004). Esto puede aumentar la exposición a los ectoparásitos,
resultando difícil separar los efectos inmunosupresores de esta hormona de
aquellos sobre la actividad motora (Veiga et al. 1998;
Olsson et al. 2000). De nuevo en este sentido, el
experimento de traslocación recíproca con captura-recaptura realizado por Barrientos y Megía-Palma (2021) en la
población de estudio demostró un efecto directo de la distancia recorrida sobre
el aumento del número de ácaros en machos de P. algirus que fue
independiente de los posibles efectos confundidores de la testosterona y dando
apoyo a nuestras interpretaciones en el presente estudio.
Contribución de los autores
Rodrigo Megía-Palma: conceptualización, metodología, revisión
de los datos, análisis estadísticos, escritura – primer borrador. Claudia
Mediavilla: escritura – revisión y edición, generación y revisión de los datos.
Senda Reguera: generación de datos. Rafael Barrientos: generación de datos, escritura
– revisión y edición.
Disponibilidad de datos
los datos están accesibles en el repositorio de datos de
Mendeley con el DOI https://doi.org/10.17632/bc6zphghvz.1
Financiación, permisos requeridos, potenciales
conflictos de interés y agradecimientos
RB tenía en el momento de la
realización del estudio una beca postdoctoral de la Comunidad de Madrid
(2018T1/AMB10374 and 2022-5a/AMB-24242).
La Comunidad de Madrid y la Consejería de Medio Ambiente,
Vivienda y Agricultura autorizaron la captura de lagartijas (código de licencia
10/184672.9/22). Patrimonio Nacional nos autorizó para trabajar en el Monte de
El Pardo.
Los autores declaran que no tienen conflictos de interés en
relación con este estudio.
Agradecemos a José Antonio de los Ríos Solera (Universitat
de Barcelona) que amablemente nos cedió la fotografía ventral del macho de Acanthodactylus
mostrada en la Figura 2d. Los comentarios de dos
revisores han contribuido a la mejor puesta en valor de nuestros datos.
Referencias
Argaez, V., Pruett, J.A., Seddon,
R.J., Solano-Zavaleta, I., Hews, D.K., Zúñiga-Vega, J.J. 2021. Steroid hormones, ectoparasites, and color: Sex, species, and
seasonal differences in Sceloporus lizards. General and
Comparative Endocrinology 304, 113717. https://doi.org/10.1016/j.ygcen.2021.113717
Barrientos, R.,
Megía-Palma, R. 2021. Associated costs of mitigation-driven
translocation in small lizards. Amphibia-Reptilia 42, 275-282. https://doi.org/10.1163/15685381-bja10040
Beilharz, R.G., Luxford, B.G., Wilkinson, J.L. 1993. Quantitative
genetics and evolution: is our understanding of genetics sufficient to explain
evolution? Journal of Animal Breeding and Genetics 110(1-6),
161-170. https://doi.org/10.1111/j.1439-0388.1993.tb00728.x
Belliure, J. 2015. Lagartija
colirroja – Acanthodactylus erythrurus. En: Enciclopedia Virtual de los
Vertebrados Españoles. Salvador, A., Marco, A. (Eds.). Museo Nacional de
Ciencias Naturales, Madrid. http://www.vertebradosibericos.org/
Belliure, J., Carrascal, L.M., Diaz, J.A. 1996. Covariation
of thermal biology and foraging mode in two Mediterranean lacertid
lizards. Ecology 77(4), 1163-1173. https://doi.org/10.2307/2265585
BeVier, G.T., Ayton, C., Brock, K.M. 2022. It ain’t easy being orange:
lizard colour morphs occupying highly vegetated microhabitats suffer greater
ectoparasitism. Amphibia-Reptilia 43, 287-297. https://doi.org/10.1163/15685381-bja10097
Blackburn, D.G. 1998. Resorption of oviductal eggs and embryos in squamate
reptiles. Herpetological Journal 8, 65-71.
Busack, S.D.,
Jaksic, F.M. 1982. Autoecological observations
of Acanthodactylus erythrurus (Sauria: Lacertidae) in
Southern Spain. Amphibia-Reptilia 3, 237-256. https://doi.org/10.1163/156853882X00464
Carranza, S., Harris, D.J.,
Arnold, E.N., Batista, V., González-de La Vega, J.P. 2006. Phylogeography
of the lacertid lizard, Psammodromus algirus, in Iberia and across the
Strait of Gibraltar. Journal of Biogeography 33(7), 1279-1288.
https://doi.org/10.1111/j.1365-2699.2006.01491.x
Carrascal, L.M., Diaz, J.A., Cano, C. 1989. Habitat selection in Iberian Psammodromus
species along a Mediterranean successional gradient. Amphibia-Reptilia 10,
231-242. https://doi.org/10.1163/156853889X00403
Carretero, M.A., Llorente,
G.A. 1995. Thermal and temporal patterns of two Mediterranean
Lacertidae. Scientia Herpetologica 1995, 213-223.
Castilla, A.M., Barbadillo, L.J., Bauwens, D. 1992. Annual variation in
reproductive traits in the lizard Acanthodactylus erythrurus. Canadian
Journal of Zoology 70(2), 395-402. https://doi.org/10.1139/z92-059
Cox, R.M.,
John-Alder, H.B. 2007. Increased mite parasitism as
a cost of testosterone in male striped plateau lizards Sceloporus virgatus. Functional
Ecology 21(2), 327-334. https://doi.org/10.1111/j.1365-2435.2007.01251.x
De los Ríos-Solera, J.A., Megía-Palma, R.,
Tarriza, A., Blázquez-Castro, S., Barrientos, R., Barja, I. 2024. Three yellow patches differently correlate with escape behaviour,
morphological traits, leukocytes, parasites, and hormones in a lizard
species. Behavioral Ecology and Sociobiology 78(9), 1-12. https://doi.org/10.1007/s00265-024-03515-x
Díaz, J.A. 1993. Breeding coloration, mating opportunities, activity,
and survival in the lacertid lizard Psammodromus algirus. Canadian
Journal of Zoology 71(6), 1104-1110. https://doi.org/10.1139/z93-150
Díaz, J.A., Alonso-Gómez, A.L., Delgado, M.J. 1994. Seasonal variation of gonadal development, sexual steroids, and
lipid reserves in a population of the lizard Psammodromus algirus. Journal
of Herpetology 28(2), 199-205. https://doi.org/10.2307/1564621
Díaz, J.A., Izquierdo‐Santiago, R., Llanos‐Garrido, A. 2022. Lizard thermoregulation revisited after two decades of global
warming. Functional Ecology 36(12), 3022-3035. https://doi.org/10.1111/1365-2435.14192
Drechsler,
R.M., Monrós, J.S. 2019. Body growth and its
implications in population dynamics of Acanthodactylus erythrurus (Schinz,
1834) in the Eastern Iberian Peninsula. Amphibia-Reptilia 40,
305-312. https://doi.org/10.1163/15685381-20181087
Drechsler, R.M., Belliure, J.,
Megía-Palma, R. 2021. Phenological and intrinsic predictors of
mite and haemacoccidian infection dynamics in a Mediterranean community of
lizards. Parasitology 148(11), 1328-1338. https://doi.org/10.1017/S0031182021000858
Dupoué, A., Blaimont, P., Rozen‐Rechels, D., Richard, M.,
Meylan, S., Clobert, J., Miles, D.B., et al. 2020. Water availability and
temperature induce changes in oxidative status during pregnancy in a viviparous
lizard. Functional Ecology 34(2), 475-485. https://doi.org/10.1111/1365-2435.13481
French, S.S., Johnston, G.I.H., Moore, M.C. 2007. Immune activity
suppresses reproduction in food‐limited female tree lizards Urosaurus ornatus. Functional
Ecology 21(6), 1115-1122. https://doi.org/10.1111/j.1365-2435.2007.01311.x
Gandon, S.,
Michalakis, Y. 2002. Local adaptation, evolutionary
potential and host–parasite coevolution: interactions between migration,
mutation, population size and generation time. Journal of Evolutionary
Biology 15(3), 451-462. https://doi.org/10.1046/j.1420-9101.2002.00402.x
Horn, C.J., Luong, L.T. 2021. Trade-offs between reproduction and behavioural
resistance against ectoparasite infection. Physiology & Behavior 239,
113524. https://doi.org/10.1016/j.physbeh.2021.113524
Iraeta, P., Díaz, J.A., Bauwens, D. 2007. Nest-site selection by Psammodromus
algirus in a laboratory thermal gradient. Journal of Herpetology 41,
360-364. https://doi.org/10.1670/0022-1511(2007)41[360:NSBPAI]2.0.CO;2
Klukowski, M. 2004. Seasonal changes in abundance of host-seeking chiggers
(Acari: Trombiculidae) and infestations on fence lizards, Sceloporus
undulatus. Journal of Herpetology 38(1), 141-144. https://doi.org/10.1670/127-03N
Klukowski, M., Nelson, C.E. 2001. Ectoparasite loads in free-ranging
northern fence lizards, Sceloporus undulatus hyacinthinus: effects of
testosterone and sex. Behavioral Ecology and Sociobiology 49,
289-295. https://doi.org/10.1007/s002650000298
Klukowski, M., Ackerson, B., Nelson, C.E. 2004. Testosterone and daily
activity period in laboratory-housed mountain spiny lizards, Sceloporus
jarrovi. Journal of Herpetology 38(1), 120-124. https://doi.org/10.1670/27-03NA
Knutie, S.A., Wilkinson, C.L., Kohl, K.D., Rohr, J.R. 2017. Early-life disruption of amphibian microbiota decreases later-life
resistance to parasites. Nature Communications 8, 86. https://doi.org/10.1038/s41467-017-00119-0
Lafferty,
K.D., Kuris, A.M. 1999. How environmental stress
affects the impacts of parasites. Limnology and Oceanography 44(3),
925-931. https://doi.org/10.4319/lo.1999.44.3_part_2.0925
Li, S.R., Hao, X., Wang, Y., Sun, B.J., Bi, J.H., Zhang, Y.P., Janzen,
F.J., et al. 2018. Female lizards choose warm, moist nests that improve
embryonic survivorship and offspring fitness. Functional Ecology 32(2),
416-423. https://doi.org/10.1111/1365-2435.12995
Marler, C.A.,
Moore, M.C. 1989. Time and energy costs of
aggression in testosterone-implanted free-living male mountain spiny lizards (Sceloporus
jarrovi). Physiological Zoology 62(6), 1334-1350. https://doi.org/10.1086/physzool.62.6.30156216
Martín, J., Forsman, A. 1999. Social costs and
development of nuptial coloration in male Psammodromus algirus lizards:
an experiment. Behavioral
Ecology 10(4),
396-400. https://doi.org/10.1093/beheco/10.4.396
Megía-Palma, R., Martínez, J.,
Cuervo, J.J., Belliure, J., Jiménez-Robles, O., Gomes, V., Cabido, C., et al.
2018. Molecular evidence for host–parasite co-speciation
between lizards and Schellackia parasites. International
Journal for Parasitology 48(9-10), 709-718. https://doi.org/10.1016/j.ijpara.2018.03.003
Megía-Palma, R., Arregui, L.,
Pozo, I., Žagar, A., Serén, N., Carretero, M.A., Merino, S. 2020. Geographic patterns of stress in insular lizards reveal
anthropogenic and climatic signatures. Science of the Total Environment 749,
141655. https://doi.org/10.1016/j.scitotenv.2020.141655
Megía-Palma, R., Barrientos,
R., Gallardo, M., Martínez, J., Merino, S. 2021. Brighter is
darker: the Hamilton–Zuk hypothesis revisited in lizards. Biological Journal
of the Linnean Society 134(2), 461-473. https://doi.org/10.1093/biolinnean/blab081
Megía-Palma, R., Barja, I.,
Barrientos, R. 2022a. Fecal glucocorticoid metabolites and
ectoparasites as biomarkers of heat stress close to roads in a Mediterranean
lizard. Science of the Total Environment 802, 149919. https://doi.org/10.1016/j.scitotenv.2021.149919
Megía-Palma, R., Merino, S.,
Barrientos, R. 2022b. Longitudinal
effects of habitat quality, body condition, and parasites on colour patches of
a Mult ornamented lizard. Behavioral Ecology and Sociobiology 76,
73. https://doi.org/10.1007/s00265-022-03182-w
Megía‐Palma, R., Redondo, L., Blázquez‐Castro, S., Barrientos, R.
2023a. Differential recovery ability from infections by two blood parasite
genera in males of a Mediterranean lacertid lizard after an experimental
translocation. Journal of Experimental Zoology Part A: Ecological and
Integrative Physiology 339(9), 816-824. https://doi.org/10.1002/jez.2732
Megía-Palma, R., Martínez, J.,
Fitze, P.S., Cuervo, J.J., Belliure, J., Jiménez-Robles, O., Cabido, C., et al.
2023b. Genetic diversity, phylogenetic position, and
co-phylogenetic relationships of Karyolysus, a common blood parasite of
lizards in the western Mediterranean. International Journal for
Parasitology 53(4), 185-196. https://doi.org/10.1016/j.ijpara.2022.12.006
Megía‐Palma, R., Cuervo, J.J., Fitze, P.S., Martínez,
J., Jiménez‐Robles, O.,
De la Riva, I., Reguera, S., et al. 2024. Do sexual
differences in life strategies make male lizards more susceptible to parasite
infection? Journal of Animal Ecology 93(9), 1338-1350. https://doi.org/10.1111/1365-2656.14154
Møller, A.P., Dufva, R., Allander, K. 1993. Parasites
and the evolution of host social behavior. Advances in the Study of
Behavior 22, 60405-2. https://doi.org/10.1016/S0065-3454(08)60405-2
Nordling, D., Andersson, M., Zohari, S., Lars, G. 1998. Reproductive effort
reduces specific immune response and parasite resistance. Proceedings
of the Royal Society of London B: Biological Sciences 265(1403),
1291-1298. https://doi.org/10.1098/rspb.1998.0432
Norris, K., Anwar, M., Read, A.F. 1994. Reproductive effort influences the
prevalence of haematozoan parasites in great tits. Journal of Animal
Ecology 63(3), 601-610. https://doi.org/10.2307/5226
Olsson, M., Wapstra, E., Madsen, T., Silverin, B. 2000. Testosterone,
ticks and travels: a test of the immunocompetence-handicap hypothesis in
free-ranging male sand lizards. Proceedings of the Royal Society of
London B: Biological Sciences 267(1459), 2339-2343. https://doi.org/10.1098/rspb.2000.1289
Perry, G.,
Garland Jr., T. 2002. Lizard home ranges revisited:
effects of sex, body size, diet, habitat, and phylogeny. Ecology 83(7),
1870-1885. https://doi.org/10.1890/0012-9658(2002)083[1870:LHRREO]2.0.CO;2
Pollock,
N.B., John-Alder, H.B. 2020. Sex-and age-specific
effects are superimposed on seasonal variation in mite parasitism in Eastern
Fence Lizards (Sceloporus undulatus). Journal of Herpetology 54(3),
273-281. https://doi.org/10.1670/18-167
Pollock, N.B., Vredevoe, L.K., Taylor, E.N. 2012. The effect of exogenous
testosterone on ectoparasite loads in free‐ranging
western fence lizards. Journal of Experimental Zoology Part A:
Ecological Genetics and Physiology 317(7), 447-454. https://doi.org/10.1002/jez.1737
Rafferty, A.R., Reina, R.D.
2012. Arrested embryonic development: a review of strategies
to delay hatching in egg-laying reptiles. Proceedings of the Royal
Society B: Biological Sciences 279(1737), 2299-2308. https://doi.org/10.1098/rspb.2012.0100
Rasmussen, N.L., van Allen, B.G., Rudolf, V.H. 2014. Linking phenological
shifts to species interactions through size‐mediated
priority effects. Journal of Animal Ecology 83(5),
1206-1215. https://doi.org/10.1111/1365-2656.12203
Rivera-Rea, J.,
González-Morales, J.C., Fajardo, V., Megía-Palma, R., Bastiaans, E., Manjarrez,
J. 2022. Phenological variation in parasite load and
inflammatory response in a lizard with an asynchronous reproductive
cycle. The Science of Nature 109(4), 34. https://doi.org/10.1007/s00114-022-01793-x
Roberts, M.L., Buchanan, K.L., Evans, M.R. 2004. Testing the
immunocompetence handicap hypothesis: a review of the evidence. Animal
Behaviour 68(2), 227-239. https://doi.org/10.1016/j.anbehav.2004.05.001
Roff, D.A. (eds.) 2002. Life history evolution. Sunderland,
Sinauer Associates. https://doi.org/10.1016/B978-0-12-384719-5.00087-3
Saino, N., Ferrari, R.P., Romano, M., Ambrosini, R., Møller, A.P. 2002. Ectoparasites and reproductive trade-offs in the barn swallow (Hirundo
rustica). Oecologia 133(2), 139-145. https://doi.org/10.1007/s00442-002-1015-4
Salvador, A. 2015. Lagartija
colilarga – Psammodromus algirus. En: Enciclopedia Virtual de los
Vertebrados Españoles. Salvador, A., Marco, A. (Eds.). Museo Nacional de
Ciencias Naturales, Madrid. http://www.vertebradosibericos.org/
Salvador, A., Martin, J.,
López, P. 1995. Tail loss reduces home range size and access
to females in male lizards, Psammodromus algirus. Behavioral
Ecology 6(4), 382-387. https://doi.org/10.1093/beheco/6.4.382
Salvador, A., Veiga, J.P.,
Martin, J., López, P., Abelenda, M., Puerta, M. 1996. The cost
of producing a sexual signal: testosterone increases the susceptibility of male
lizards to ectoparasitic infestation. Behavioral Ecology 7(2),
145-150. https://doi.org/10.1093/beheco/7.2.145
Smolinský, R., Hiadlovská, Z., Maršala, Š., Škrabánek, P., Škrobánek, M.,
Martínková, N. 2022. High predation risk decimates survival during the
reproduction season. Ecology and Evolution 12(10), e9407. https://doi.org/10.1002/ece3.9407
Svensson, P.A.,
Wong, B.B.M. 2011. Carotenoid-based signals in
behavioural ecology: a review. Behaviour 148(2), 131-189. https://doi.org/10.1163/000579510X548673
Tamar, K., Carranza, S., Sindaco, R., Moravec, J., Trape, J.F., Meiri, S.
2016. Out of Africa: Phylogeny and biogeography of the
widespread genus Acanthodactylus (Reptilia: Lacertidae). Molecular
Phylogenetics and Evolution 103, 6-18. https://doi.org/10.1016/j.ympev.2016.07.003
Uller, T.,
Olsson, M. 2003. Prenatal exposure to testosterone
increases ectoparasite susceptibility in the common lizard (Lacerta vivipara). Proceedings
of the Royal Society of London B: Biological Sciences 270(1526),
1867-1870. https://doi.org/10.1098/rspb.2003.2451
Van der Most, P.J., de Jong, B., Parmentier, H.K., Verhulst, S. 2011. Trade‐off
between growth and immune function: a meta‐analysis of
selection experiments. Functional Ecology 25(1), 74-80.
https://doi.org/10.1111/j.1365-2435.2010.01800.x
Veiga, J.P., Salvador, A., Merino,
S., Puerta, M. 1998. Reproductive effort affects immune
response and parasite infection in a lizard: a phenotypic manipulation using
testosterone. Oikos 82(2), 313-318. https://doi.org/10.2307/3546971
Warner, D.A., Lovern, M.B., Shine, R. 2007. Maternal nutrition affects
reproductive output and sex allocation in a lizard with environmental sex
determination. Proceedings of the Royal Society B: Biological Sciences 274(1611),
883-890. https://doi.org/10.1098/rspb.2006.0105
Wieczorek, M., Rektor, R., Najbar, B., Morelli, F. 2020. Tick parasitism is
associated with home range area in the sand lizard, Lacerta agilis. Amphibia-Reptilia 41, 479-488. https://doi.org/10.1163/15685381-bja10018
Wang, Y., Zeng, Z.G., Li, S.R., Bi, J.H., Du, W.G. 2016. Low precipitation aggravates the impact of extreme high temperatures
on lizard reproduction. Oecologia 182, 961-971. https://doi.org/10.1007/s00442-016-3727-x
Watson, M.J. 2013. What drives population-level effects of parasites?
Meta-analysis meets life-history. International Journal for Parasitology:
Parasites and Wildlife 2, 190-196. https://doi.org/10.1016/j.ijppaw.2013.05.001
Wu, Q., Richard, M., Rutschmann, A., Miles, D.B., Clobert, J. 2019.
Environmental variation mediates the prevalence and co-occurrence of parasites
in the common lizard. Zootoca vivipara. BMC Ecology 19,
44. https://doi.org/10.1186/s12898-019-0259-3
Material Suplementario / Supplementary material
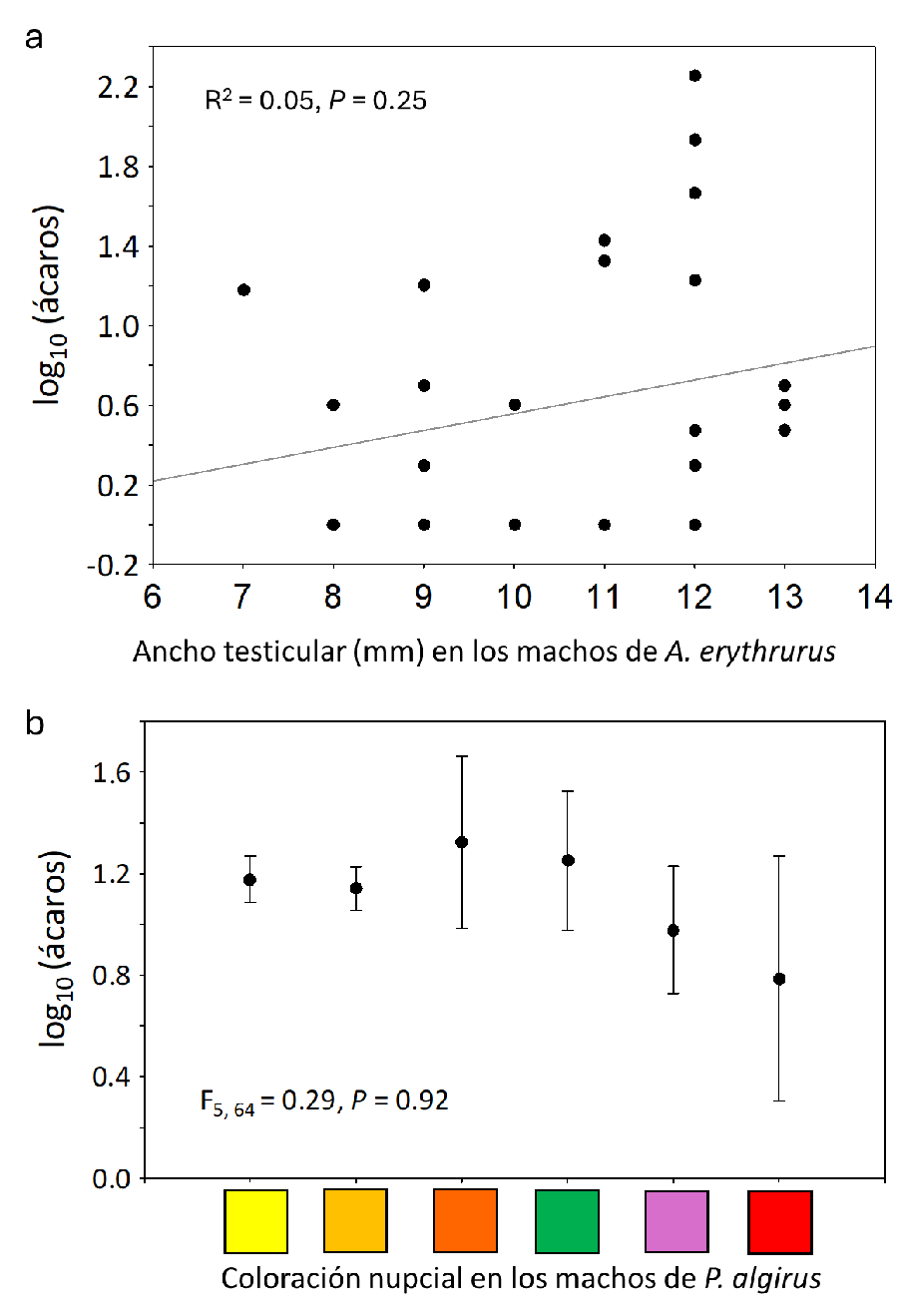
Figura S1. Relación del número de ácaros con (a)
el ancho testicular en A. erythrurus y con (b) el
grupo de coloración nupcial en los que fueron clasificados los machos de P.
algirus en función de la superficie pigmentada (de menor a mayor superficie
pigmentada de izquierda a derecha, ver también en el texto principal la Figura 2).
Figure S1. Relationship
between the number of mites with (a) testis width in A. erythrurus and with (b) the nuptial coloration group in
which P. algirus males were classified based on the pigmented
surface area (from least to most pigmented surface from left to right; see also
Figure 2 in the main
text).
![]() , Claudia
Mediavilla2
, Claudia
Mediavilla2 ![]() , Senda Reguera3
, Senda Reguera3 ![]() , Rafael
Barrientos2
, Rafael
Barrientos2 ![]()




