Introducción
Los ecosistemas de aguas
continentales albergan una fracción desproporcionadamente grande de la biodiversidad
total del mundo en relación con la superficie que ocupan (Dudgeon et al. 2006). Dicha diversidad ha experimentado un declive mayor
en comparación con la de los ecosistemas marinos y terrestres durante las
últimas décadas (Naiman
et al. 2008), reflejando el
deficiente estado de conservación actual en el que se encuentran debido al
cambio global (Tickner
et al. 2020). En este contexto, los
ríos se consideran ecosistemas críticos para la fauna (Baron et al. 2002), principalmente desde una concepción clásica que
concibe a los ríos con aguas permanentes, proporcionando hábitats y funciones
esenciales mayoritariamente para especies acuáticas y semiacuáticas (Vörösmarty et al. 2010; Bernhardt y Palmer 2011). Sin embargo, la interrupción recurrente del flujo
de agua superficial a lo largo de los cursos fluviales es parte de la
hidrología natural de los ríos en todas las zonas climáticas, incluidas las
alpinas, polares y templadas (Messager et al. 2021). De hecho, estos ríos temporales (RTs), es decir, sistemas que
periódicamente dejan de fluir, constituyen aproximadamente el 60% de la red
fluvial global en la actualidad (Messager et al. 2021) y se esperan que aumenten debido al cambio climático, a los usos de
suelo y a la creciente extracción de agua (Gleick y
Palaniappan 2010; Döll y Schmied 2012). En este contexto, es necesaria la adopción de un
nuevo paradigma para gestión de los ríos y la protección de su biodiversidad
que considere dicha intermitencia del flujo.
Los RTs se expanden y
contraen en respuesta a las condiciones variables del flujo de agua superficial
(Stanley et
al. 1997; Doering et al. 2007), generando mosaicos cambiantes de hábitats lóticos
(aguas corrientes), lénticos (pozas) y terrestres (cauces secos) que alternan
entre las fases fluyentes y secas (Fig. 1).
Dentro de estas fases, se pueden distinguir cuatro estados hidrológicos (aguas
corrientes, pozas desconectadas, cauces secos y restablecimiento de flujo)
controlados por la dinámica espacio-temporal de la intermitencia del flujo (es
decir, la magnitud, frecuencia, duración y extensión de los eventos de secado y
reflujo). Dicha dinámica regula la diversidad, la disposición espacial y el
recambio temporal de los distintos hábitats, así como la conectividad entre
ellos (Sánchez-Montoya
et al. 2023).
Durante las dos últimas
décadas, numerosos estudios han reconocido como la presencia de la fase seca en
los ríos ejerce una fuerte presión selectiva que controla la estructura,
composición y rasgos biológicos de las comunidades acuáticas, incluyendo tapetes
microbianos (Sabater
et al. 2017), algas (Tornés y Sabater 2010), macrófitos (Westwood et al. 2006), invertebrados acuáticos (Boulton y Lake 1992; Datry 2012; Sánchez-Montoya et al. 2018) y peces (Matthews y Marsh-Matthews 2003). Como resultado, por lo general, los RTs albergan
comunidades acuáticas distintas y menos diversas que la de los ríos permanentes
(Sánchez-Montoya
et al. 2007; Datry 2012). En contraste, recientemente algunos trabajos
comienzan a evidenciar los efectos positivos de la fase seca de los ríos sobre
la fauna terrestre y, por ende, en su biodiversidad en general (p. ej. Sánchez-Montoya et
al. 2016a; 2017; Steward et al. 2022).
El objetivo de este trabajo
es presentar a los RTs como ecosistemas relevantes para la fauna invertebrada y
vertebrada terrestre, desafiando la visión clásica de que los ríos son
meramente importantes para la fauna acuática y semi-acuática. Para ello, se
describe la diversidad de fauna terrestre que albergan los RTs, se sintetizan
las funciones ecológicas que proporcionan y los servicios ecosistémicos que
brindan a través de dicha fauna. Por último, se discuten las implicaciones de
la inclusión de la fauna terrestres en la gestión y conservación de estos
ecosistemas, y se identifican lagunas de concomimientos y preguntas de
investigación sobre la relevancia de los RTs para la fauna terrestre.
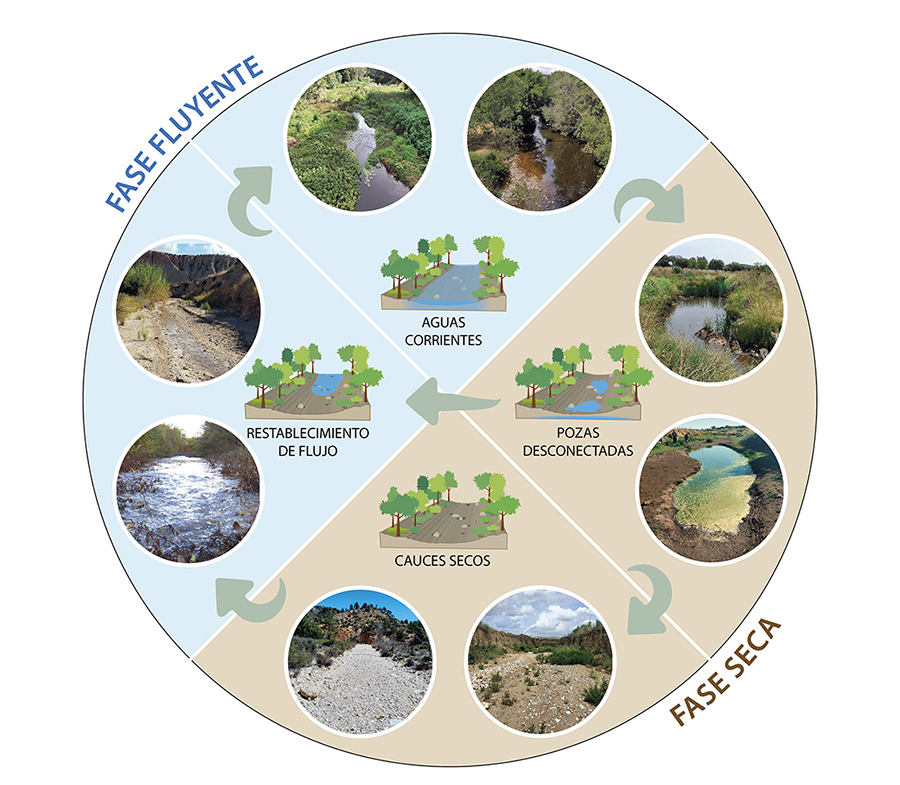
Figura 1. Alternancia de las fases fluyente y
seca en ríos temporales, y tránsito entre los cuatro estados hidrológicos
generados por las condiciones hidrológicas cambiantes: aguas corrientes, pozas
desconectadas, cauces secos y restablecimiento de flujo. Fotos:
María Mar Sánchez-Montoya.
Figure 1. Alternation of wet and dry phases in temporary rivers, and
transition between the four hydrological states generated by changing
hydrological conditions: flowing waters, disconnected pools, dry channels and
rewetting. Photos: María Mar Sánchez-Montoya.
Biodiversidad taxonómica y funcional de la fauna
terrestre invertebrada y vertebrada en los RTs
Los invertebrados terrestres
están presentes en una gran variedad de hábitats fluviales, incluidos zonas
riparias, llanuras aluviales, orillas y barras expuestas de los cauces tanto en
ríos permanentes como temporales. Sin embargo, la existencia de la fase seca en
los RTs proporciona beneficios a los invertebrados terrestres (Sánchez-Montoya et
al. 2020a, 2020b; Steward et al. 2022), convirtiéndolos en componentes biológicos claves de estos sistemas
desde una perspectivas ecológica, funcional y taxonómica.
La desaparición de la lámina
de agua en los cauces, durante la fase seca, trae como consecuencia la
expansión del hábitat terrestre y su colonización por parte de invertebrados
terrestres desde los ecosistemas adyacentes (riberas y laderas; Steward et al. 2011; Sánchez-Montoya et al. 2020a). Esto permite la existencia de una comunidad diversa
y abundante en los cauces secos, descrita en varios continentes (África: Wishart 2000; Sánchez-Montoya et al. 2020b; Australia: Steward et al. 2011; Europa: Steward
et al. 2011; Corti y Datry 2016; Sánchez-Montoya et al. 2016a, 2020a).
Estudios recientes han detectado que la diversidad de esta comunidad en dichos
hábitats es similar (Steward et al. 2011; Sánchez-Montoya et
al. 2020b) o incluso mayor (Sánchez-Montoya et
al. 2016a, 2020a) a la de las riberas o laderas adyacentes, ya que
está compuesta no solo por taxones propios de los hábitats terrestres
adyacentes sino también por especies únicas de los cauces (Steward et al. 2011; Sánchez-Montoya et al. 2016a, 2020a, 2020b). Consecuentemente, los cauces secos contribuyen
significativamente a la diversidad regional de las cuencas fluviales.
La comunidad de invertebrados
terrestres en los RTs está compuesta mayoritariamente por artrópodos (Fig. 2A), principalmente de las clases Insecta (insectos),
Arachnida (arañas (Fig.
2B, 2C),
garrapatas, escorpiones y ácaros (Fig. 2D)),
Chilopoda (ciempiés), Collembola (colémbolos, Fig. 2E),
Diplopoda (milpiés), Diplura (dipluros), Gastropoda (caracoles) y Protura
(proturos). También están presentes otros grupos minoritarios como Isopoda
(cochinillas, Fig.
2F). El grupo de insectos,
mayoritario en la comunidad, incluye órdenes como Archaeognatha (pececillos de
cobre, Fig. 2G), Blattodea (cucarachas), Coleoptera (escarabajos, Fig. 2H), Diptera (moscas verdaderas), Embioptera
(tejedores), Hemiptera (chinches y pulgones), Hymenoptera (hormigas, Fig. 2I), Mantodea (mantis), Neuroptera (crisopas),
Orthoptera (saltamontes y grillos), Psocoptera (piojos de libro), Thysanoptera
(trips) y Zygentoma (peces plateados). De todos ellos, los más abundantes en
los RTs son las hormigas, arañas, coleópteros y colémbolos (Sánchez-Montoya et
al. 2016a, 2020a, 2020b; Steward et al. 2017, 2022). La
composición de dicha comunidad está fuertemente influenciada a escala local por
variables como la humedad y el tamaño del sustrato que conforman los cauces
secos (Sánchez-Montoya
et al. 2016a; Steward et al. 2017).
Desde un punto de vista
funcional, la comunidad de invertebrados de los RTs está formada por
depredadores, carroñeros, herbívoros, detritívoros y parásitos (Williams 1993). Los depredadores y carroñeros han sido descritos a
menudo como los grupos funcionales dominantes, especialmente en ríos con
extensas áreas de barras de grava expuestas (Steward et al. 2012; Steward
et al. 2017), debido principalmente a
la presencia de subsidios acuáticos con alto valor energético durante la fase
fluyente. Los depredadores terrestres que habitan las riberas, como las arañas
lobo (Lycosidae) y los escarabajos carábidos (Carabidae), típicamente se
alimentan de insectos acuáticos emergentes que pueden llegar a representar el
85% de sus dietas (Paetzold et al. 2005). Además,
estos grupos se ven claramente beneficiados del secado de los cauces que les
proporciona especies acuáticas atrapadas en ellos como subsidio temporal, como
peces (Tomberlin
et al. 2017) e invertebrados (p. ej.
heterópteros) (Lake
2003). De forma similar detritívoros
y herbívoros, como hormigas y ortópteros, encuentran subsidio alimentario en
los cauces secos en forma de algas y macrófitos (Steward et al. 2022), y también vegetación terrestre que invade los cauces secos
principalmente en ríos efímeros (Tooth y Nanson 2000; Sánchez-Montoya
et al. 2020b). Por todo ello, cabe
esperar que la alternancia de las fases fluyente y seca afecte
significativamente a los componentes de las redes alimentarias acuáticas y
terrestres a través de cambios en la disponibilidad de recursos alimentarios, y
a sus interacciones entre niveles tróficos. Sin embargo, la comprensión de los
flujos recíprocos de energía entre el ecosistema fluvial y el terrestre
adyacente en los RTs sigue siendo insuficiente.
La comunidad de fauna
terrestre vertebrada presente en los RTs es diversa y abundante a escala global
(Sánchez-Montoya
et al. 2017). Sin embargo, estas
comunidades han recibido una escasa atención, posiblemente porque la fase seca
de los ecosistemas cae en un vacío entre los campos de la ecología terrestre y
la limnología. Como resultado, son escasos los estudios que se han centrado en
describir y comprender las interacciones entre los RTs y la fauna terrestre
vertebrada (Leggett
et al. 2003; Levick et al. 2008; Sánchez-Montoya et al. 2017; 2023).
Entre los distintos grupos de
fauna vertebrada destacan, por una notable presencia en estos ecosistemas, los
reptiles, aves y mamíferos. Los anfibios también están presentes, pero con una
baja diversidad atribuida a la mayor dependencia de este grupo por hábitats
acuáticos permanentes. En regiones áridas e hiperáridas, estos ecosistemas
cobran un especial protagonismo ya que actúan como oasis lineales para la fauna
terrestre (Leggett
et al. 2003, 2004), ofreciendo condiciones más húmedas que el paisaje
circundante (Krueper
1993). Un estudio reciente realizado
en ríos europeos (Sánchez-Montoya et al. 2022) ha demostrado que, a través de las fases fluyentes y
secas, los RTs exhiben mayor abundancia y riqueza de especies de vertebrados
que los ríos permanentes colindantes, especialmente aquellos sometidos a
períodos secos más cortos. Algunas de las especies que habitan los RTs se
encuentran actualmente gravemente amenazadas por numerosas actividades
antrópicas (Tabla 1), lo que pone de manifiesto el papel principal que
pueden desempeñar estos ecosistemas en la conservación de fauna vertebrada
terrestre de especial interés.

Figura 2. Invertebrados terrestres presentes en
ríos temporales. A) Trampa de caída con coleóptero en un cauce seco. B) Araña (Gnaphosidae),
C) Hogna radiata (Lycosidae), D) ácaro (Acaridae), E) colémbolo del
Orden Poduromorpha, F) isópodo del género Armadillidium
(Armadillidiidae), G) Archaeognata (Machilidae), H) coleóptero del género Pimelia
(Tenebrionidae) e I) hormigas del género Messor (Formicidae) en
diferentes cauces de ríos Mediterráneos de la Península Ibérica. Fotos: A, B.
María Mar Sánchez-Montoya MM; C-I: Jesús Miñano.
Figure 2. Terrestrial invertebrates inhabiting temporary rivers. A) Pitfall
trap containing a coleoptera in a dry riverbed. B) Spider (Gnaphosidae), C) Hogna
radiata (Lycosidae), D) mite (Acaridae), E) springtail belonging to the
Order Poduromorpha, F) isopod belonging to the genus Armadillidium
(Armadillidiidae), G) Archaeognata (Machilidae), H) beetle belonging to the
genus Pimelia (Tenebrionidae), and I) ants belonging to genus Messor
(Formicidae) in different channels in Mediterranean rivers of the Iberian
Peninsula. Photos: A, B. María Mar Sánchez-Montoya MM; C-I: Jesús
Miñano.
Tabla 1. Algunos
ejemplos de especies de vertebrados terrestres en peligro (EN) y en peligro
crítico de extinción (CR) según la Lista Roja de la UICN, su distribución,
principales amenazas y referencias que describen su presencia en ríos
temporales.
Table 1. Some
examples of terrestrial vertebrate threatened species according to IUCN Red
List (EN: Endangered; CR: Critically endangered), their distribution, major
threats and references describing their presence in temporary rivers.
Funciones ecológicas proporcionadas por los RTs durante
la fase seca a la fauna terrestre
Los RTs no solo actúan como
proveedores de agua y alimento a la fauna terrestre durante la fase
fluyente, sino también durante la fase seca a través de pozas desconectadas y/o
cauces secos. Las pozas desconectadas, ya sean temporales o permanentes,
representan un recurso de agua esencial para una amplia variedad de fauna
vertebrada. Esto ocurre no solo en regiones áridas y semiáridas durante la
estación seca, como sucede con la mayoría de los mamíferos en África (Skinner y Chimimba
2005), sino
también en áreas templadas durante el verano (Fig. 3A)
(Sánchez-Montoya
et al. 2022). Además de suministrar
agua, estas pozas proporcionan una gran cantidad de alimento en forma de
organismos acuáticos (invertebrados, peces, anfibios y reptiles) que utilizan
estos hábitats como refugio, debido a su tolerancia a las condiciones físico-químicas
del agua estancada (Bogan et al. 2019). Así,
mamíferos como la nutria en África (Aonyx capensis) y en Europa (Lutra
lutra) explotan estas pozas en las estaciones secas alimentándose de peces,
cangrejos y ranas, entre otras especies acuática (Skinner y Chimimba
2005; Ruíz-Olmo et al. 2007).
A pesar de la falta de agua
en superficie, también los cauces secos pueden proporcionar agua a la fauna
terrestre. Megafauna como el elefante africano (Loxodonta africana) o
algunos equinos como los burros salvajes de Arizona (Equus asinus) (Fig. 3B) excavan en busca de agua subsuperficial en los
lechos secos creando pozas desconectadas que proporcionan agua, alimento y
refugio a otros animales, actuando como principales ingenieros del paisaje (Naiman y Rogers 1997; Lundgren et al. 2021). Este comportamiento es común en otras especies que habitan RTs en
África como babuinos (Papio spp; Hamilton 1985),
orix del cabo (Oryx gazelle) y cebras de llanura (Equus quagga) (Epaphras et al. 2008).
Los cauces secos también
actúan como proveedores esenciales de alimento para algunas especies,
proporcionando recursos en forma de organismos acuáticos que no son capaces de
escapar a hábitats acuáticos permanentes cercanos durante el secado (Velasco y Millán
1998; Bogan y Boersma 2012) o utilizar la zona hiporreica como refugio (Stubbington 2012). Los peces con baja capacidad de dispersión e
invertebrados de dispersión pasiva, así como algas y macrófitos, actúan como
subsidio alimentario temporal para algunos invertebrados terrestres que
colonizan los cauces durante la fase seca (Williams y Hynes 1977). La dinámica temporal de la comunidad de
invertebrados terrestres observada en los cauces secos podría estar relacionada
con la pérdida de humedad en estos hábitats y su efecto en el recurso
alimentario (Sánchez-Montoya et al. 2016a, 2020a; Steward et al. 2022). Tras el aumento de la riqueza y abundancia de taxones como
escarabajos, arañas y hormigas en los cauces durante los primeros días de
secado, se produce un descenso que se podría atribuir a la pérdida de
palatabilidad por falta de humedad de los recursos. Este subsidio acuático
proporcionado por los cauces secos también es utilizado por la fauna
vertebrada. En RTs europeos se ha observado como diferentes vertebrados
utilizan más frecuentemente los cauces para alimentarse que las zonas de ribera
durante la fase seca (Sánchez-Montoya et al. 2002). Por ejemplo, los jabalís (Sus scrofa) se
pueden alimentar de invertebrados acuáticos como cangrejos atrapados en los
cauces secos (comunicación personal: Juan Luis Nevado Hurtado). Similarmente,
algunos mamíferos insectívoros como los murciélagos no solo se alimentan en los
RTs consumiendo los insectos aéreos que emergen de las pozas desconectadas,
sino también de los invertebrados terrestres que han colonizado los cauces
secos (Seidman
y Zabel 2001). Incluso los cauces
efímeros, caracterizados por la escasez de recursos en forma de especies
acuáticas al estar sometidos a fases secas muy prolongadas, proporcionan
alimento por medio de las especies terrestres que albergan. La vegetación
terrestre que coloniza los cauces secos desde hábitats terrestres adyacentes (Tooth y Nanson 2000), sirve como alimento para invertebrados herbívoros y
omnívoros (Sánchez-Montoya et al. 2020b),
así como vertebrados como ungulados en Europa (Fig. 3C,
3D) (Sánchez-Montoya et al. 2022) o elefantes (Fig. 3E)
y ungulados en África (Western 1975; Sánchez-Montoya et
al. 2017). Además, los cauces secos
suministran presas vivas como invertebrados terrestres para depredadores como
las arañas (Sánchez-Montoya et al. 2016a, 2020a) y micromamíferos para carnívoros como zorros o
mapaches (Fig. 3F) (Sánchez-Montoya et al. 2022).
Los cauces secos también
proporcionan importantes funciones ecológicas al actuar como refugios y zonas
de descanso y apareamiento para la fauna terrestre. Algunos invertebrados
terrestres se entierran en los sedimentos no saturados (Langhans y Tockner
2014) y en los tapetes de algas (Steward et al. 2017) y hojarasca de los cauces secos (Fig. 3G) (Sánchez-Montoya et al. 2020b) como estrategia de protección a las altas
temperaturas que se registran en superficie. Las arañas lobo de la familia
Lycosidae tienen preferencia por cauces secos con sustrato grueso (Moring y Steward 1994) donde se protegen de altas temperaturas, mientras
otros coleópteros seleccionan sustratos finos donde cavar en busca de mayor
humedad y alimento y evitar depredadores (Hashimoto y Hayashi 2012). Otras arañas como Latrodectus revivensis
utiliza los cauces secos como hábitats prioritarios para el apareamiento (Segev et al. 2003). También algunos vertebrados terrestres utilizan los
cauces secos como hábitats preferentes durante su ciclo de vida. Es el caso del
cerdo hormiguero nativo de África (Orycteropus afer) que excava en los
cauces secos para crear madrigueras donde vive y se reproduce (Fig. 3H), evitando altas temperaturas extremas y depredadores
durante el día (Melton
1976). De manera similar, el
cocodrilo de agua dulce australiano (Crocodylus johnsoni) anida en
madrigueras arenosas en los cauces durante la estación seca cerca de pozas
desconectadas (Webb
et al. 1983), y la tortuga mora (Testudo
graeca, Fig. 3I) selecciona cauces secos arenosos mediterráneos como
sitios de anidación (Anadón et al. 2005).
Por último, recientemente se
ha evidenciado que los cauces secos actúan como corredores de movimiento
preferentes para la fauna terrestre (Sánchez-Montoya et al. 2023). Los invertebrados terrestres se mueven en estos
hábitats en búsqueda de pareja, presas, nuevos hábitats y/o alimento (Sánchez-Montoya et
al. 2016a, Steward et al. 2022). La escasa vegetación de estos cauces, en la mayoría
de los casos, podrían facilitar sus movimientos. De hecho, algunos artrópodos
terrestres exhiben las tasas netas de desplazamiento más altas en hábitats con
baja resistencia espacial local (sensu Heydemann 1957) como el suelo desnudo y, por el contrario, tasas más bajas en áreas con
vegetación (Wiens
y Milne 1989).
Similarmente, los vertebrados
terrestres también utilizan los cauces secos como vías de movimiento, incluso
más frecuentemente que los hábitats terrestres adyacentes (es decir, zonas de
ribera y laderas; Sánchez-Montoya et al. 2016b, 2022). Así
estos hábitats, desprovistos de vegetación inmersos en una matriz vegetada,
parecen conferir una menor resistencia al movimiento (sensu Zeller et al. 2012) facilitando el desplazamiento de fauna, operando de
forma similar a las denominadas estructuras lineales suaves (SLD) como caminos
sin pavimentar y cortafuegos (Haddad et al. 2003). Esta función ha sido registrada en RTs en Europa para ungulados y
carnívoros (Fig 3J), entre otros, (Sánchez-Montoya et al. 2022) y en Ámerica del Norte para carnívoros como los
pumas (Puma concolor) y linces (Lynx rufus) (Fig. 3K), ungulados e incluso aves (Fig. 3L)
(Sánchez-Montoya
et al. 2023). En algunos casos, la
presencia de pozas desconectadas en los cauces secos puede atraer a diversas
especies. En África, por ejemplo, los cocodrilos del Nilo (Martin 2008), elefantes y ungulados (Kok y Nel 1996; Skinner y Chimimba 2005) utilizan lechos de ríos secos como corredores de
movimiento hacia pozas permanentes.

Figuras 3. Los ríos temporales durante la fase
seca proporcionan funciones ecológicas claves para la fauna terrestre
invertebrada y vertebrada. A) Poza desconectada como recurso en forma de
agua para ungulados como el ciervo mulo (Odocoileus hemionus, Coyote
Creek en EEUU). B) Agua subsuperficial como recurso para asnos salvajes
(Equus asinus, Black Canyon en EEUU) capaces de excavar en los cauces
secos. Vegetación terrestre de los cauces secos como alimento para: C)
jabalís (Sus scrofa, Arroyo Ubacas en España), D) cabras montesas
(Capra pirenaica, Rambla de la Rogativa en España) y E) elefantes
africanos (Loxodonta africana, Río Ugab en Namibia). F) Presas
vivas en cauces secos como alimento para mapaches boreales (Procyon lotor,
Coyote Creek en EEUU). G) Acumulación de materia orgánica vegetal en los
cauces secos como refugio-hábitat para invertebrados terrestres (Río Ugab en
Namibia). H) Madriguera excavada en un cauce seco por cerdos hormigueros
(Orycteropus afer, Rio Ugab en Namibia). I) Cauce seco como lugar
de anidación para la tortuga mora (Testudo graeca). Cauces secos como
corredores de movimiento para diversos vertebrados como: J) el zorro
rojo (Vulpes vulpes, Rambla de la Rogativa en España), K) el lince rojo (Lynx rufus,
Coyote Creek en EEUU) y L) pavos salvajes (Meleagris gallopavo,
Coyote Creek en EEUU). Fotos: A, F, K, L: Pablo Rodríguez-Lozano; B: Erick
Lundgren; C-E, G-J: María Mar Sánchez-Montoya.
Figuras 3. Temporary rivers during their dry phase provide key ecological
functions for terrestrial invertebrate and vertebrate fauna. A) Disconnected pool as water subsidy
for ungulates such as mule deer (Odocoileus hemionus, Coyote Creek in
the USA). B) Subsurface
water as a resource for wild asses (Equus asinus, Black Canyon in the
USA) which are able of digging in dry channels. Terrestrial vegetation of dry
riverbeds as food for: C) wild boars (Sus scrofa, Arroyo Ubacas in Spain),D) mountain goats (Capra pirenaica, Rambla de la Rogativa in Spain) and E) african elephants (Loxodonta africana, Ugab River in
Namibia). F) Live prey in dry channels as food for boreal raccoons (Procyon lotor, Coyote Creek
in the USA).G) Debris piles in dry channels as refuge-habitat for terrestrial invertebrates (Ugab
River in Namibia). H) Burrow excavated in a dry riverbed by aardvark (Orycteropus afer, Ugab
River in Namibia). I) Dry riverbed as a nesting place for the Moorish turtle (Testudo graeca).
Dry riverbeds as movement corridors for different vertebrates such as: J) the red fox (Vulpes vulpes,
Rambla de la Rogativa in Spain), K) the red lynx (Lynx rufus, Coyote Creek in the USA) and L)wild turkeys (Meleagris gallopavo,Coyote Creek in the USA). Photos: A, F, K, L: Pablo Rodríguez-Lozano; B:
Erick Lundgren; C-E, G-J: María Mar Sánchez-Montoya.
Los RTs como proveedores de servicios ecosistémicos a
través de la fauna terrestre
Los RTs proporcionan una
amplia variedad de servicios ecosistémicos de aprovisionamiento, regulación,
apoyo y culturales que contribuyen al bienestar humano, de forma similar a los
ríos permanentes (Datry
et al. 2017). Sin embargo, la
alternancia de las fases fluyente y seca, generan tasas variables de provisión
debido al efecto de la intermitencia de flujo (Koundouri et al. 2017). Actualmente, la mayoría de las aproximaciones a la
evaluación de estos servicios en los RTs se centran exclusivamente en
comunidades acuática y semi-acuática como componentes biológicos responsable
del aprovisionamiento de estos servicios (Koundouri et al. 2017). Sin embargo, la fauna terrestre asociada a los RTs
también contribuye de forma relevante a la generación de servicios
ecosistémicos (Vidal-Abarca et al. 2023).
Entre
los servicios de aprovisionamiento más relevantes prestados por la fauna
terrestre de los RTs destacan el de provisión de alimento. Muchos taxones de
invertebrados terrestres que habitan los RTs son considerados insectos
comestibles por su alto valor nutritivo, y constituyen un alimento tradicional
para más de 300 grupos étnicos en 113 países del mundo (Van Huis et al. 2013). Por ejemplo, las termitas que se encuentran con
frecuencia en los RTs de África, además de otras regiones del mundo, son el
segundo insecto más consumido a nivel mundial (Pal y Roy 2014). En cuanto a fauna vertebrada, son numerosas las especies utilizadas
como alimento. Este es el caso del conejo europeo (Oryctolagus cuniculus),
comúnmente observado en cauces secos y márgenes ribereños en áreas semiáridas
mediterráneas (Sánchez-Montoya et al. 2016b, 2017). Esta especie ha sido un componente clave de la
dieta mediterránea y en la subsistencia humana desde el Paleolítico Superior en
la península ibérica (Hockett y Bicho 2000). Otros ejemplos notables incluyen al jabalí en Europa y al cerdo
hormiguero en África, que han sido persistentemente cazados para el consumo de
su carne (Liebenberg
2006). Similarmente, los canguros que
habitan los RTs en Australia han sido tradicionalmente consumidos por nativos
aborígenes del noroeste de Australia (Withnell 1901, datos sin publicar), y su consumo
actualmente se ha visto incrementado frente a otras carnes disponibles (Ratnasiri y Bandara
2017). Además, los RTs proporcionan servicio de abastecimiento de agua gracias
al comportamiento de creación de pozas con agua de origen subsuperficial
mediante excavación de cauces secos por parte de algunos vertebrados
terrestres, los cuales a menudo generan la única fuente de agua en grandes
áreas o acortan las distancias entre los cuerpos de agua existentes (Lundgren et al. 2021).
Entre los servicios de
regulación proporcionados por la fauna vertebrada en los RTs destaca el que
dispensan muchas especies actuando como polinizadores al ser consumidores
oportunistas de néctar (Herrera 2020). Este es el caso
de los Haplothrips sp. (Orden Thysanoptera) que polinizan flores de Mollugo
cerviana, una hierba anual que crece en los RTs de India (Maddala y Aluri 2019), o de los lagartos machos adultos de Podarcis
lilfordi que consumen el néctar y polinizan a Ephedra fragilis en
cauces temporales mediterráneos (Garilleti et al. 2012; Fuster y Traveset 2019).
Los servicios de soporte
brindados por los RTs están especialmente vinculados al movimiento de la fauna
vertebrada (Ortega
et al. 2023) a lo largo de los cauces
secos. Dichos desplazamientos pueden tener importantes consecuencias ecológicas
al promover la dispersión de semillas, influir en el ciclo de nutrientes y la
formación del suelo. Por ejemplo, el estiércol depositado por los elefantes
africanos en los lechos secos de los ríos contiene semillas de árboles de
Acacia que se dispersan durante la fase fluyente cuando aumentan las
posibilidades de germinación (Dudley 2006).
Así mismo, el zorro que utiliza frecuentemente los RTs en el sureste de España
como corredores (Sánchez-Montoya et al. 2022),
actúa como dispersor de semillas para muchas especies del hábitat prioritario
para la conservación formado por matorral arborescente mediterráneo con Ziziphus
loto (Cancio
et al. 2017). De manera más general,
los vertebrados terrestres en cauces secos pueden excretar y agregar nutrientes
que son suministrados a los productores primarios a través de la descomposición
y remineralización de sus heces por parte del microbiota, reciclarlos o
trasladarlos a través de hábitats (Delibes-Mateos et al. 2008). De esta forma, las letrinas de conejos europeos que
se observan comúnmente en las riberas de las RTs mediterráneos constituyen
fértiles islas de suelo (Puigdefábregas et al. 1996) y facilitan el crecimiento de las plantas (Delibes-Mateos et
al. 2008). Este mismo efecto de
fertilización es esperable por parte de la amplia variedad de vertebrados
terrestres que utiliza los cauces secos de los ríos como corredores de
movimiento (Sánchez-Montoya et al. 2023).
Finalmente, la mera presencia
de fauna vertebrada en los RTs proporciona servicios culturales como es el uso
recreacional. Este es el caso de megafauna como los elefantes africanos,
componentes visualmente destacados en los RTs durante la estación seca, cuya
atracción para turistas internacionales (Lindsey et al. 2007) genera importantes rendimientos económicos (Naidoo et al. 2016). A su vez, estas especies pueden generar oportunidades
educativas en los RTs, como es el caso de la tortuga mora en el sureste de
España (Pérez et
al. 2004).
Implicaciones para la conservación y gestión
La preservación y
restauración de los regímenes de flujo natural, que generan el mosaico
cambiante de hábitats acuáticos y terrestres, son vitales para preservar las
funciones ecológicas proporcionadas por los RTs a la fauna terrestres, al igual
que para mantener los procesos y servicios ecosistémicos que estas especies
sustentan (Fig. 4).
Los esfuerzos de conservación
en ríos se han centrado en cursos de agua permanentes y en la biodiversidad
acuática que albergan, resultando en una subrepresentación de los RTs en las
redes de áreas protegidas (Stubbington et al. 2018). Sin embargo, ignorar la existencia de la fase seca
de los ríos y la importancia de esta para la fauna terrestre puede limitar la
toma de decisiones en cuanto a estrategias de conservación de la biodiversidad
en los dominios terrestres y acuáticos continentales. En un estudio reciente, Bruno et al. (2022) evaluaron el valor de conservación de los RTs en base
a sus comunidades acuáticas y terrestres en unas de las regiones más áridas de
Europa. Detectaron que la identificación de sitios prioritarios de conservación
exclusivamente en base a la biodiversidad acuática conlleva a la
subrepresentación de taxones terrestres, concluyendo en la necesidad de
integrar a las comunidades terrestres y acuáticas al identificar áreas
prioritarias para conservación en cuencas con presencia de RTs.
La evaluación ecológica de
los RTs constituye uno de los mayores retos actuales en la gestión que no ha
sido adecuadamente considerado por la Directiva Marco del Agua (DMA,
2000/60/EC; European Commission 2000) (Nikolaidis et al. 2013; Skoulikidis et al. 2017; Stubbigton et al. 2019). Esto ha generado, junto con los escenarios futuros
de cambio climático, una urgente necesidad de aumentar el conocimiento
ecológico de la estructura y funcionamiento de estos ecosistemas fluviales, así
como de generar nuevas herramientas que permitan la evaluación el estado
ecológico de los ecosistemas fluviales durante su fase seca (Prat et al. 2014). En este sentido, recientemente los invertebrados
comienzan a ser considerados como bioindicadores de calidad de los ríos durante
su fase seca (ver Bonada et al. en este número), dada su respuesta ante las
perturbaciones antrópicas más comunes en los RTs (Steward et al. 2018).
La creciente apreciación de la importancia de los cauces secos para el
movimiento de vertebrados terrestres podría tener importantes implicaciones
para la conservación. Esto es particularmente relevante en el contexto del
diseño de red de corredores que conecten hábitats críticos y que ayuden a
mitigar los impactos de la fragmentación y la pérdida de hábitats (Clerici y Vogt 2013). Hasta ahora, el modelado de conectividad entre
áreas protegidas para la fauna vertebrada ha tenido en cuenta casi
exclusivamente a las riberas como elemento de conectividad fluvial (p. ej. de la Fuente et al.
2018), debido a su reconocida importancia
para el movimiento de anfibios, reptiles, mamíferos y aves (Hilty et al. 2006). Sin embargo, la inclusión de los cauces secos como
corredores de movimiento podría mejorar la conectividad natural entre hábitats,
particularmente en áreas donde la urbanización e infraestructuras han
disminuido la conectividad a lo largo las riberas fluviales. En esta línea, Sánchez-Montoya et
al. (2023) demostraron recientemente
como la inclusión de los RTs en una red de corredores diseñada para la conexión
de hábitats protegidos de la Red Natura 2000 en base a propiedades de los
bosques, arbustos y zonas ribereñas, puede incrementar hasta el doble su longitud,
aumentando significativamente la conexión entre dichos hábitats protegidos.
Figura 4. La conservación y gestión de los ríos
debe considerar tanto la fase fluyente como la seca, y por tanto sus
comunidades acuáticas y terrestres asociadas.
Figure
4. The conservation and management of temporary
rivers must consider both the flowing and dry phases, and therefore their
associated aquatic and terrestrial communities.
Vacíos de conocimiento y líneas futuras de investigación
Actualmente existen numerosos
vacíos de conocimiento y preguntas centrales sobre las conexiones entre los RTs
y la fauna terrestre (Tabla 2). Esto dificulta la toma de decisiones para la conservación
y gestión de estos ecosistemas y su biodiversidad. Destacan las carencias
básicas como el conocimiento de las especies terrestres que habitan los RTs, su
relación con las distintas fases hidrológicas y los factores que
gobiernan estas comunidades en comparación con los de los ecosistemas
terrestres. Igualmente, se requiere mayor comprensión de la interacción entre
comunidades acuáticas y terrestres en estos ecosistemas, las funciones ecológicas
que desempeñan y los efectos del cambio climático en la distribución de la
fauna terrestre en los RTs. La integración de disciplinas como la limnología,
la ecología terrestre y la hidrología ofrece una plataforma prometedora para
futuras líneas de investigación que aborden de manera satisfactoria el estudio
de las interacciones entre los RTs y sus comunidades biológicas.
Tabla 2.
Algunos de los principales vacíos de conocimiento y preguntas de
investigación sobre el papel ecológico de los ríos temporales para la fauna
invertebrada y vertebrada terrestre.
Table 2. Some of major knowledge gaps
and research questions concerning ecological role of temporary river for
invertebrate and vertebrate terrestrial fauna.
Agradecimientos
La autora agradece a las editoras del monográfico la
invitación a participar en esta edición de la revista y a los revisores
anónimos por sus comentarios para mejorar la versión final del artículo.
Agradecimientos a Joaquín Pajarón por su colaboración con el diseño gráfico de
las figuras. Este estudio está financiado por el proyecto “DRY-Guadalmed:
Herramientas avanzadas para la evaluación del estado ecológico de ríos
temporales mediterráneos durante la fase seca” (PID2021-126143OB-C21 y
PID2021-126143OB-C22) financiado por el Ministerio de Ciencia e Innovación
(MCIN/AEI/10.13039/501100011033/).
Referencias
Alavarado-Diaz, J.,
Garcia-Garrido, P., Suazo-Ortuño, I. 2002. Food habits of a
paedomorphic population of the Mexican salamander, Ambystoma ordinarium
(Caudata: mbystomatidae). The Southwestern Naturalist 28: 100-102.
Anadón, J.D., Giménez, A., Pérez, I., Martínez, M., Esteve, M.A. 2005. The
role of relief in local abundance patterns of the spurthighed tortoise Testudo
graeca graeca in south-east Spain. Herpetological Journal 15:
285-290.
Baron, J.S., Poff, N.L., Angermeier, P.L., Dahm, C.N., Gleick, P.H.,
Hairston Jr., et al. 2002. Meeting ecological and societal needs for
freshwater. Ecological Applications 12: 1247-1260.
Bernhardt,
E.S., Palmer, M.A. 2011. River restoration: the
fuzzy logic of repairing reaches to reverse catchment scale degradation. Ecological
Applications 21: 1926-1931.
Bickford, D., Iskandar, D., Barlian, A. 2008. A lungless frog discovered on
Borneo. Current Biology 18: R374-R375.
Bogan, M.T.,
Boersma, K.T. 2012. Aerial dispersal of aquatic
invertebrates along and away from arid-land streams. Freshwater Science
31: 1131-1144.
Bogan, M.T., Leidy, R.A., Neuhaus, L., Hernandez, C.J., Carlson, S.M.
2019. Biodiversity value of remnant pools in an intermittent stream during the
great California drought. Aquatic Conservation: Marine and Freshwater
Ecosystems 29: 976-989.
Boulton,
A.J., Lake, P.S. 1992. The ecology of two
intermittent streams in Victoria, Australia. Temporal changes in faunal
composition. Freshwater Biology 27: 123-138.
Bruno, D., Hermoso, V., Sánchez-Montoya, M.M., Belmar, O.,
Gutiérrez-Cánovas, C., Cañedo-Argüelles, M. 2022. Ecological relevance of
non-perennial rivers for the conservation of terrestrial and aquatic
communities. Conservation Biology 36: e13982.
Cancio, I., González-Robles,
A., Bastida, J.M., Isla, J., Manzaneda, A.J., Salido, T., Rey, P.J. 2017. Landscape degradation afects red fox (Vulpes vulpes) diet and
its ecosystem services in the threatened Ziziphus lotus scrubland
habitats of semiarid Spain. Journal of Arid Environments 145: 24-34.
Carter, S.K.,
Rosas, F.C.W. 1997. Biology and conservation of
the Giant Otter Pteronura Brasiliensis. Mammal Review 27: 1-26.
Clerici, N.,
Vogt, P. 2013. Ranking European regions as
providers of structural riparian corridors for conservation and management
purposes. International Journal of Applied Earth Observation and
Geoinformation 21: 477-483.
Corti, R., Datry, T. 2016. Terrestrial and aquatic invertebrates in the riverbed of
an intermittent river: parallels and contrasts in community organisation. Freshwater
Biology 61: 1308-1320.
Datry, T. 2012. Benthic and hyporheic invertebrate assemblages along a
flow intermittence gradient: effects of duration of dry events. Freshwater
Biology 57: 563-574.
Datry, T., Boulton, A.J., Bonada, N., Fritz, K., Leigh, C., Sauquet, E.,
et al. 2017.Flow intermittence and ecosystem services in rivers of the
Anthropocene. Journal of Applied Ecology 55: 1-12.
de la Fuente, B.,
Mateo-Sánchez, M.C., Rodríguez, G., Gastón, A., de Ayala, R.P., Colomina-Pérez,
D., Saura, S. 2018. Natura 2000 sites, public forests and
riparian corridors: the connectivity backbone of forest green infrastructure.
Land Use Policy 75: 429-441.
Delibes-Mateos, M.,
Delibes, M., Ferreras, P., Villafuerte. R. 2008. Key role of
European rabbits in the conservation of the Western Mediterranean Basin
hotspot. Conservation Biology 22: 1106-1117.
Doering, M.,
Uehlinger, U., Rotach, A., Schlaepfer, D.R., Tockner, K. 2007. Ecosystem
expansion and contraction dynamics along a large Alpine alluvial corridor
(Tagliamento River, Northeast Italy). Earth Surface Processes and Landforms
32: 1693-1704.
Döll, P.,
Schmied, H.M. 2012. How is the impact of climate
change on river flow regimes related to the impact on mean annual runoff? A
global-scale analysis. Environmental Research Letters 7: 1-11.
Dubey, S., Sinsch, U., Dehling, M.J., Chevalley, M., Shine, R. 2013.
Population demography of an endangered lizard, the Blue Mountains Water Skink. BMC
Ecology 13: 4.
Dudgeon, D., Arthington, A.H., Gessner, M.O., Kawabata, Z., Knowler, D.J.,
Lévêque, C., et al. 2006. Freshwater biodiversity: importance, threats, status
and conservation challenges. Biological Reviews 81: 163-182.
Dudley, J.P. 2006. Seed dispersal by elephants in semiarid woodland
habitats of Hwange National Park, Zimbabwe. Biotropica 32:
556e561.
Epaphras, A.M., Gereta, E.,
Lejora, I.A., Ole Meing’ataki, G.E., Ng’umbi, G., Kiwango, Y., et al. 2008. Wildlife water utilization and importance of artificial waterholes
during dryseason at Ruaha National Park, Tanzania. Wetlands Ecology and
Management 16: 183-188.
Ernst, C.H.,
Lovich, J.E. 2009. Turtles of the United States
and Canada. Johns Hopkins University Press. Baltimore, USA.
Estades, C.F., Aguirre, J., Escobar, M.A.H., Tomasevic, J.A., Vukasovic,
M.A., Tala, C. 2007. Conservation status of the Chilean Woodstar, Eulidia
yarrellii. Bird Conservation International 17: 163-175.
European
Commission, 2000. Directive 2000/60/EC of the
European parliament of the council of 23 October 2000 establishing a framework
for Community action in the field of water policy. Official Journal of the
European Communities L327: 1-72.
Fong, J.J., Qiao, G.X. 2010. New localities of endangered Chinese turtles from
museum specimens and the practical and ethical challenges using and reporting
natural history collection data. Zootaxa 2393: 59-68.
Fuster, F.,
Traveset, A. 2019. Evidence for a double
mutualistic interaction between a lizard and a Mediterranean gymnosperm, Ephedra
fragilis. AoB Plants 11: 1-11.
Garilleti, R., Calleja,
J.A., Lara, F. 2012. Vegetación ribereña de los ríos y ramblas de la España
meridional (península y archipiélagos). Centro de Publicaciones, Secretaría
General Técnica, Ministerio de Agricultura, Alimentación y Medio Ambiente. Madrid, España.
Ghaffari, H., Taskavak, E., Karami, M. 2008. Conservation status of the
Euphrates Softshell Turtle, Rafetus euphraticus, in Iran. Chelonian
Conservation and Biology 7, 223-229.
Gleick,
P.H., Palaniappan, M. 2010. Peak water limits to
freshwater withdrawal and use. Proceedings of the National Academy of
Sciences 107: 11155-11162.
Haddad, N.M., Bowne, D.R., Cunningham, A., Danielson, B.J., Levey, D.J.,
Sargent, S., Sprira, T. 2003.Corridor use by diverse taxa. Ecology 84:
609-615.
Hamilton, W.J. 1985. Demographic consequences of a food and water shortage
to desert chacma baboons, Papio ursinus. International Journal of
Primatology 6: 451-462.
Hashimoto,
K., Hayashi, F. 2012. Structure and function of the
large pronotal horn of the sand-living anthicid beetle Mecynotarsus tenuipes. Entomological
Science 15: 274-279.
Hero, J.M.,
Morrison, C. 2004. Frog declines in Australia:
global implications. Herpetological Journal 14: 175-186.
Herrera, C.M. 2020. Flower traits, habitat, and phylogeny as predictors of
pollinator service: a plant community perspective. Ecological Monographs
90: e01402.
Heydemann, B. 1957. Die Biotopstruktur als Raumwiderstand und Raumfülle für
die Tierwelt. Verhandlungen der Deutschen Zoologischen Gesellschaft 20:
332-347.
Hilty, J.A., Lidicker Jr., W.Z., Merelender, A.M. 2006. Corridor
Ecology: The Science and Practice of Linking Landscapes for Biodiversity
Conservation. Island Press, Washington, DC., USA.
Hockett,
B.S., Bicho, N.F. 2000. The rabbits of Picareiro
cave: small mammal hunting during the late upper palaeolithic in the Portuguese
Estremadura. Journal of Archaeological Science 27: 715-723.
Hou, M., Wu, Y., Yang, K., Zheng, S., Yuan, Z., Li, P. 2014. A missing
geographic link in the distribution of the genus Echinotriton (Caudata:
Salamandridae) with description of a new species from southern China. Zootaxa
3895: 89-102.
Kok, O.B., Nel, J.A.J. 1996. The Kuiseb River as a linear oasis in the Namib
Desert. African Journal of Ecology 34: 39-47.
Koundouri, P., Boulton, A.J., Datry, T., Souliotis, I. 2017. Ecosystem
services, values, and societal perceptions of intermittent rivers and ephemeral
streams. En: Datry, T., Bonada, N., Boulton, A. (Eds), Intermittent Rivers
and Ephemeral Streams: Ecology and Management, pp. 455-476 Burlington:
Academic Press.
Krueper, D.J. 1993. Conservation Priorities in Naturally Fragmented and
Human-Altered Riparian Habitats of the Arid West. General Technical Report
RM-43; U.S. Department of Agriculture, Cornell Laboratory of Ornithology,
Cornell University, Ithaca, NY, USA.
Lake, P.S. 2003. Ecological effects of perturbation by drought in
flowing waters. Freshwater Biology 48: 1161-1172.
Lakshminarayanan, N., Karanth, K.K., Goswami,V.R., Vaidyanathan, S., Karanth, K.U.
2016. Determinants of dry season habitat use by Asian elephants in the Western
Ghats of India. Journal of Zoology 298: 169-177.
Langhans,
S.D., Tockner, K. 2014. Is the unsaturated sediment
a neglected habitat for riparian arthropods? Evidence from a large gravel-bed
river. Global Ecology and Conservation 2: 129-137.
Leggett, K.E.A., Fennessy, J., Schneider, S. 2003. Seasonal distributions
and social dynamics of elephants in the Hoanib River catchment, north-western
Namibia. African Zoology 38: 305-316.
Leggett, K.E.A., Fennessy, J., Schneider, S. 2004. A study of animal
movement in the Hoanib River catchment, northwestern Namibia. African
Zoology 39: 1-11.
Levick, L., Fonseca, J., Goodrich, D., Hernandez, M., Semmens, D.,
Stromberg, J., et al., 2008. The Ecological and Hydrological Significance of
Ephemeral and Intermittent Streams in the Arid and Semi-Arid American Southwest.
EPA/600/R-08/134, ARS/233046, U.S. Environmental Protection Agency and
USDA/ARS. Southwest Watershed Research Center, Washington, DC., USA.
Liebenberg, L. 2006. Persistence hunting by modern hunter-gatherers. Current
Anthropology 47: 1017-1025.
Lindsey, P.A., Alexander, R., Mills, M.G.L., Romanach, S., Woodrofe, R.
2007. Wildlife viewing preferences of visitors to protected areas in South
Africa: implications for the role of ecotourism in conservation. Journal of
Ecotourism 6: 19-33.
Loutit, R. 1991. Western flowing ephemeral rivers and their importance to
the wetlands of Namibia. En: Simmons, R.E., Brown, C.J., Griffin, M. (Eds.), The
Status and Conservation of Wetlands in Namibia. pp. 135-140. Madoqua,
vol. 17(2).
Lu, Z., Zhou, F., Xie, B., Luo, Y. 2003. Discovery
of imminent rare Shinisaurus crocodilurus in Zhaoping County,Guangxi Autonomous
Region. Sichuan Journal of Zoology 2: 85-85.
Lundgren, E., Ramp, D., Stromberg, J.C., Wu, J., Nieto, N. C., Sluk, M., et
al. 2021. Equids engineer desert water availability. Science 372:
491-495.
Maddala S.,
Aluri, J.S.R. 2019. Pollination ecology of the
species Mollugo cerviana (L.) Ser. (Molluginaceae). Transylvanian
Review of Systematical and Ecological Research 21: 13-22.
Martin, S. 2008. Global diversity of crocodiles (Crocodilia, Reptilia) in
freshwater. Hydrobiologia 595: 587-591.
Matthews,
W.J., Marsh-Matthews, E. 2003. Effects of drought
on fish across axes of space, time and ecological complexity. Freshwater
Biology 48: 1232-1253.
Melton, D.A.1976. The biology of aardvark (Tubulidentata-Orycteropodidae).
Mammal Review 6: 75-88.
Messager, M.L., Lehner, B., Cockburn, C., Lamoroux, N., Pella, H., Snelder,
T., et al. 2021. Global prevalence of non-perennial rivers and streams. Nature
594: 391-397.
Mills, G., Hes, L. 1997. The Complete Book of South African Mammals. Struik,
Cape Town, South Africa.
Moring,
J.B., Stewart, K.W. 1994. Habitat partitioning by
the wolf spider (Araneae, Lycosidae) guild in streamside and riparian
vegetation zones of the Conejos River, Colorado. Journal of Arachnology
22: 205-217.
Naidoo, R., Fisher, B., Manica, A., Balmford, A. 2016. Estimating economic
losses to tourism in Africa from the illegal killing of elephants. Nature
Communications 7: 13379.
Naiman, R.J. 2008. Freshwater animal diversity assessment – Foreword. Hydrobiologia
595: 1-2.
Naiman,
R.J., Rogers, K.H. 1997. Large animals and
system-level characteristics in river corridors. Bioscience 47: 521-529.
Nikolaidis, N.P., Demetropoulou, L., Froebrich, J., Jacobs, C., Gallart, F.,
Prat, N., et al. 2013. Towards sustainable management of Mediterranean river
basins: policy recommendations on management aspects of temporary streams. Water
Policy 15: 830-849.
Ortega, Z., Arrondo, E.,
Pérez-García, J.M. 2023. Ecología del Movimiento: del análisis individual a la
provisión de servicios ecosistémicos. Ecosistemas 32: 2608.
Paetzold, A., Schubert, C.J., Tockner, K. 2005. Aquatic terrestrial linkages
along a braided-river: riparian arthropods feeding on aquatic insects. Ecosystems
8: 748-759.
Pal, P., Roy, S. 2014. Edible insects: future of human food-a review. International
Letters of Natural Sciences 26: 1-11.
Pérez, I., Giménez, A., Sánchez-Zapata, J.A., Anadón, J.D., Martínez, M.,
Esteve, M.A. 2004. Non-commercial collection of spur-thighed tortoises (Testudo
graeca graeca): A cultural problem in southeast spain. Biological
Conservation 118: 175-181.
Prat, N., Gallart, F., von Schiller, D., Polesello, S., García-Roger,
E.M., Latron, J., et al. 2014. The Mirage Toolbox: an integrated assessment
tool for temporary streams. River Research and Applications 30:
1318-1334.
Puigdefábregas, J., Alonso, J.M., Delgado, L., Domingo, F., Cueto, M., Gutiérrez,
L., et al. 1996. The Rambla Honda field site: interactions of soil and
vegetation along a catena in semiarid Southeast Spain. En: Brandt, J., Thornes,
J. (Eds), Mediterranean Desertifcation and Land Use, pp 137-168.
John Wiley, Chichester, UK.
Ratnasiri,
S., Bandara, J. 2017. Changing patterns of meat
consumption and greenhouse gas emissions in Australia: will kangaroo meat make
a diference? PLoS ONE 12: e0170130.
Ruíz-Olmo, J., Jiménez, J.,
Chacón, W. 2007. The importance of ponds for the otter (Lutra
lutra) during drought periods in Mediterranean ecosystems: a case study in
Bergantes River. Mammalia 71: 16-24.
Sabater, S., Timoner, X., Bornette, G., De Wilde, M., Stromberg, J.C.,
Stella, J.C. 2017. The biota of intermittent rivers and ephemeral streams:
Algae and vascular plants En: Datry, T., Bonada, N., Boulton, A. (Eds.), Intermittent
Rivers and Ephemeral Streams: Ecology and Management, pp. 189-216. Academic
Press. Burlington, NJ, USA.
Sánchez-Montoya, M.M., Puntí, T., Suárez, M.L., Vidal-Abarca, M.R., Rieradevall,
M., Poquet, J.M., et al. 2007. Concordance between ecotypes and
macroinvertebrate assemblages in Mediterranean streams. Freshwater Biolology
52: 2240-2255.
Sánchez-Montoya, M.M.,
von Schiller, D., Ruhi, A., Pechar, G.S., Proia, L., Miñano, J., Vidal-Abarca,
M.R., Suárez, M.L., Tockner, K. 2016a. Responses of
ground-dwelling arthropods to surface flow drying in channels and adjacent
habitats along Mediterranean streams. Ecohydrology 9: 1376-1387.
Sánchez-Montoya, M.M., Moleón, M., Sánchez-Zapata, J.A., Tockner, K. 2016b. Dry
riverbeds: corridors for terrestrial vertebrates. Ecosphere 7: e01508.
Sánchez-Montoya, M.M.,
Moleón, M., Sánchez-Zapata, J.A., Escoriza, D. 2017. The biota
of intermittent and ephemeral rivers: amphibians, reptiles, birds, and mammals.
En: Datry, T., Bonada, N., Boulton, A. (Eds), Intermittent Rivers and
Ephemeral Streams: Ecology and Management, pp. 199-322. Academic Press.
Burlington, NJ, USA.
Sánchez-Montoya, M.M., von Schiller, D., Barbera, G.G., Díaz, A.M., Arce, M.I., del
Campo, R., Tockner, K. 2018. Understanding the effects of predictability,
duration, and spatial pattern of drying on benthic invertebrate assemblages in
two contrasting intermittent streams. PLoS ONE 13: e0193933.
Sánchez-Montoya, M.M., Tockner, K., von Schiller, D., Miñano, J., Catarineu, C.,
Lencina, J.L., et al. 2020a. Dynamics of ground-dwelling arthropod
metacommunities in intermittent streams: The key role of dry riverbeds. Biological
Conservation 241: 108328.
Sánchez-Montoya, M.M.,
Guerrero-Brotons, M., Miñano, J., Gómez, R. 2020b. Effects of
debris piles and pools along dry riverbeds on nutrients, microbial activity,
and grounddwelling arthropods: a namibian ephemeral river case. Journal of
Arid Environment 175: 104082.
Sánchez-Montoya, M.M., Gómez, R., Calvo, J.F., Bartonickậ, T., Datry, T., Paril, P.
2022. Ecological values of intermittent rivers for terrestrial vertebrate
fauna. Science of the Total Environment 806: 151308.
Sánchez-Montoya, M.M., Datry, T., Ruhi, A., Carlson, S.M., Corti, R., Tockner, C.
2023. Intermittent rivers and ephemeral streams are pivotal corridors for
aquatic and terrestrial animals. BioScience 73: 291-301.
Segev, O., Ziv, M., Lubin, Y. 2003. The male mating system in a desert
widow spider. Journal of Arachnology 31: 379-393.
Seidman, V.M.,
Zabel, C.J. 2001. Bat activity along intermittent
streams in Northwestern California. Journal of Mammalogy 82: 738-747.
Sharifi, M., Bafti, S.S., Papenfuss, T., Anderson, S., Kuzmin, S., Rastegar-Pouyani,
N. 2009. Neurergus microspilotus. The IUCN Red List of Threatened
Species 2009: e.T59451A11944058. https://
dx.doi.org/10.2305/IUCN.UK.2009.RLTS.T59451A11944058.en [Accedido el 05/09/2023]
Skinner,
J.D., Chimimba, C.T. 2005. The Mammals of the
Southern African Subregion. Third Ed. Cambridge University Press,
Cambridge, UK.
Skoulikidis, N.T., Sabater, S., Datry, T., Morais, M.M., Buffagni, A.,
Dörflinger, G., et al. 2017. Non-perennial Mediterranean rivers in Europe:
status, pressures, and challenges for research and management. Science of
The Total Environment 577: 1-18.
Stanley, E.H., Fisher, S.G., Grimm, N.B. 1997. Ecosystem expansion and
contraction in streams. BioScience 47: 427-435.
Steward, A.L., Marshall, J.C., Sheldon, F., Harch, B., Choy, S., Bunn,
S.E., Tockner, K. 2011. Terrestrial invertebrates of dry river beds are not
simply subsets of riparian assemblages. Aquatic Sciences 73: 551-566.
Steward, A.L., von Schiller, D., Tockner, K., Marshall, J.C., Bunn, S.E.
2012. When the rivers runs dry: Human and ecological values of dry riverbeds.
Frontiers in Ecology and the Environment 10: 202-209.
Steward, A.L., Langhans, S.D., Corti, R., Datry, T. 2017. The biota of
intermittent rivers and ephemeral streams: Terrestrial and semiaquatic
invertebrates. En: Datry, T., Bonada, N., Boulton, A. (Eds), Intermittent
Rivers and Ephemeral Streams: Ecology and Management, pp. 245-271322.
Academic Press. Burlington, NJ, USA.
Steward, A.L., Negus, P., Marshall, J.C., Clifford, S.E., Dent, C. 2018.
Assessing the ecological health of rivers when they are dry. Ecological
Indicators 85: 537-547.
Steward, A.L., Datry, T., Langhans, S.D. 2022. The terrestrial and
semi-aquatic invertebrates of intermittent rivers and ephemeral streams. Biological
Reviews 97: 1408-1425.
Stubbington, R. 2012. The hyporheic zone as an invertebrate refuge: A review of
variability in space, time, taxa and behaviour. Marine and Freshwater
Research 63: 293-311.
Stubbington, R., Chadd, R., Cid, N., Csabai, Z., Miliša, M., Morais, M., et al.
2018. Biomonitoring of intermittent rivers and ephemeral streams in Europe:
Current practice and priorities to enhance ecological status assessments. Science
of Total Environment 618: 1096-1113.
Stubbington, R., Paillex, A., England, J., Barthès, A., Bouchez, A., Rimet, F.,
et al. 2019. A comparison of biotic groups as dry-phase indicators of
ecological quality in intermittent rivers and ephemeral streams. Ecological
Indicators 97: 165-174.
Tickner, D., Opperman, J.J., Abell, R., Acreman, M., Arthington, A.H.,
Bunn, S.E., et al. 2020. Bending the curve of global freshwater biodiversity
loss: An emergency recovery plan. BioScience 70: 330-342.
Tomberlin, J.K., Barton, B.T., Lashley, M.A., Jordan, H.R. 2017. Mass
mortality events and the role of necrophagous invertebrates. Current Opinion
in Insect Science 23: 7-12.
Tooth, S.,
Nanson, G.C. 2000. The role of vegetation in the
formation of anabranching channels in an ephemeral river, Northern plains, arid
central Australia. Hydrological Processes 14: 3099-3117.
Tornés, E.,
Sabater, S. 2010. Variable discharge alters habitat
suitability for benthic algae and cyanobacteria in a forested Mediterranean
stream. Marine and Freshwater Research 61: 441-450.
Van Huis, A., Dicke, M., van Loon, J.J.A. 2015. Insects to feed the world. Journal
of Insects as Food and Feed 1: 3-5.
Vasquez
Díaz, J., Quintero Díaz, G.E. 2007. Thamnophis
melanogaster. The IUCN Red List of Threatened Species 2007:
e.T63982A12725746. https://dx.doi.org/10.2305/IUCN.UK.2007.RLTS.T63982A12725746.en.
[Accedido el 05/09/2023].
Velasco,
J., Millán, A. 1998. Insect dispersal in a drying
desert stream: effects on temperature and water loss. The Southwestern
Naturalist 43: 80-87.
Vidal-Abarca, M.R., Nicolas-Ruiz, N., Sánchez-Montoya, M.M., Suárez, M.L. 2023. Ecosystem services provided by dry river socio-ecological systems
and their drivers of change. Hydrobiologia 850: 2585-2607.
Vörösmarty, C.J., McIntyre, P.B., Gessner, M.O., Dudgeon, D., Prusevich, A.,
Green, P., Davies, P.M. 2010. Global threats to human water security and river
biodiversity. Nature 467: 555-561.
Webb, G.J.W., Manolis, S.C., Buckworth, R. 1983. Crocodylus johnstoni
in the McKinlay River Area, N.T. VI. Nesting biology. Wildlife Research
10: 607-637.
Western, D. 1975. Water availability and its influence on the structure and
dynamics of a savannah large mammal community. African Journal of Ecology
13: 265-286.
Westwood, C.G., Teeuw, R.M., Wade, P.M., Holmes, N.T.H., Guyard, P. 2006.
Influences of environmental conditions on macrophyte communities in
drought-affected headwater streams. River Research and Applications 22:
703-726.
Wiens, J.A.,
Milne, B.T. 1989. Scaling of “landscapes” in
landscape ecology, or, landscape ecology from a beetle’s perspective. Landscape
Ecology 3: 87-96.
Williams,
D.D., Hynes, H.B. 1977. The ecology of temporary
streams II. General remarks on temporary streams. Internationale Revue der
Gesamten Hydrobiologie und Hydrographie 62: 53-61.
Williams, K.S. 1993. Use of terrestrial arthropods to evaluate restored
riparian woodlands. Restoration. Ecology 1: 107-116.
Wishart, M. 2000. The terrestrial invertebrate fauna of a temporary stream
in southern Africa. African Journal of Zoology 35: 193-200.
Zeller, K.A., McGarigal, K., Whiteley, A.R. 2012. Estimating landscape
resistance to movement: A review. Landscape Ecology 27: 777-797.



