Introducción
Las sierras Béticas, situadas en el sureste de la Península
Ibérica, albergan una rica diversidad vegetal debido a los diversos factores
históricos y ecológicos que la afectan, y que incluyen una gran variedad
climática, edáfica y altitudinal (Mota et al. 2002;
Molina-Venegas et al. 2017). Estas sierras
ya fueron identificadas como un punto de elevada biodiversidad dentro de una
zona más amplia constituida por la Cuenca Mediterránea (Médail y Quézel 1997; Fig.
1). Aunque tectónicamente se extienden desde el Estrecho de Gibraltar
hasta la provincia de Valencia e incluso las islas Baleares (el complejo
Bético-Rifeño), es en Andalucía donde presentan una mayor heterogeneidad
ambiental y donde se desarrolla una enorme variedad de tipos de vegetación.
Esta elevada heterogeneidad paisajística y geológica, unida
a la inestabilidad tectónica, ha hecho de las sierras Béticas un escenario muy
activo y propicio para los procesos de aparición y refugio de especies
vegetales. Cabe señalar la alta proporción de especies endémicas (Blanca et al. 1998; Devesa y Martínez-Sagarra 2023), buena
parte asociadas a sustratos especiales, que contribuye a la singularidad y
riqueza de estas montañas (Mota et al. 2002; Molina-Venegas et al. 2017; Buira et al. 2020). En este artículo presentamos una
síntesis simplificada de los factores históricos y ecológicos que han
contribuido a la riqueza vegetal que actualmente albergan las sierras Béticas y
reseñamos las principales amenazas a las que se enfrentan en este momento,
resultado del cambio climático y la intensificación de la actividad humana en
la región.
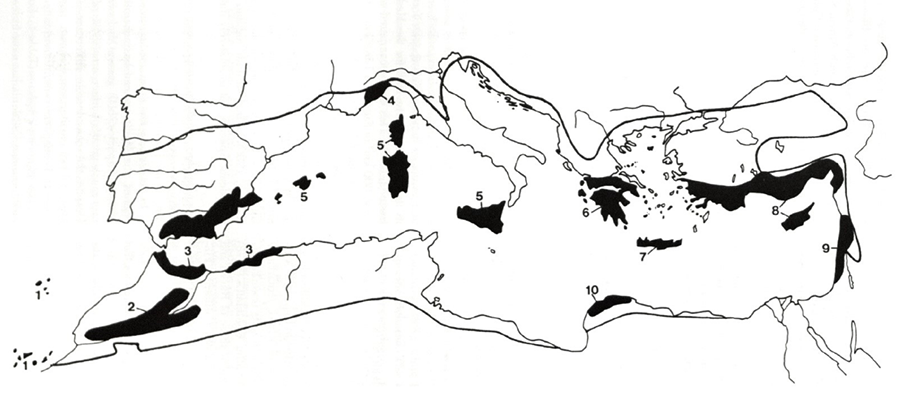
Figura 1. Zonas de alta diversidad vegetal en
la cuenca Mediterránea. Tomado de Médail y Quézel
(1997). Con permiso de Missouri Botanical Garden Press, St. Louis, MO.
Figure 1. Areas of high plant diversity in the Mediterranean basin. Taken
from Médail and Quézel
(1997). With permission from Missouri Botanical
Garden Press, St. Louis, MO.
Diversidad vegetal de las sierras Béticas en el contexto
andaluz
Para una mejor perspectiva de la diversidad vegetal Bética,
resulta conveniente situarla en su contexto regional. Andalucía posee una flora
vascular integrada por no menos de 4091 especies (Cueto
et al. 2018), si bien desde entonces han sido detectados en el territorio
taxones antes no reconocidos y se han descrito otros nuevos. Estos datos
revelan que Andalucía posee la mayor diversidad de plantas vasculares de la
España peninsular ‒cuya flora se estima en unas 6176 especies– y comprende casi
el 64% de aquella. Además de esta notable riqueza florística, Andalucía cuenta
con un alto número de endemismos peninsulares e íbero-marroquíes. Es difícil
sin embargo establecer cuántos endemismos estrictamente andaluces habitan en el
territorio, pues son muchos los cambios habidos respecto a anteriores
aproximaciones, unas veces porque la información corológica ha acabado
excluyendo algunos taxones inicialmente considerados como endémicos y otras
veces porque, al restringirse al territorio andaluz, se excluyen taxones cuya
distribución se extiende al noroeste de Marruecos. De acuerdo con los datos
disponibles en la actualidad, los endemismos vasculares estrictamente endémicos
de Andalucía ascienden a 364 especies (Devesa
y Martínez-Sagarra 2023) y son 3 los géneros endémicos del territorio: Hymenostemma
(Kunze) Kunze ex Willk., Rothmaleria Font Quer (ambos Asteraceae), y Gadoria
Güemes y Mota (Plantaginaceae) —un cuarto, Castrilanthemum Vogt y
Oberpr. (Asteraceae), siendo Bético, trasciende mínimamente los límites
políticos de Andalucía—, un número muy elevado que supone casi el 22 % del
total de los existentes en la Península Ibérica (Devesa y Martínez-Sagarra 2023). De los
taxones endémicos estrictamente andaluces recogidos por Devesa y
Martinez-Sagarra (364 especies, 395 taxones), tan solo 54 están recogidos en la
Red List of Threatened Species de la UICN (IUCN
2023). En el Catálogo Andaluz de Especies Amenazadas (Decreto 23/2012 de 14
de febrero, BOJA de 27 de marzo (Junta de
Andalucía 2012)), que considera toda la diversidad existente, se indican
183 taxones en peligro de extinción y vulnerables, incluyendo 13 Pteridofitas,
2 Gimnospermas y 168 Angiospermas.
Las sierras Béticas contribuyen de manera muy destacada a
esta gran diversidad vegetal de Andalucía, particularmente en lo que se refiere
a los endemismos, si bien sus patrones de distribución son aún poco conocidos
debido sobre todo a problemas de escala y nivel de detalle (Molina Venegas et al. 2017; Buira et al. 2020). Existe un conocimiento
relativamente bueno de la presencia de plantas endémicas en algunas zonas, lo
que ha permitido identificar puntos de elevada biodiversidad en áreas como
Sierra Nevada-Filabres, Trevenque-Almijara, Cazorla o Ronda (Lorite et al. 2007; Cañadas
et al. 2014). Sin embargo, existe poca información sobre patrones
espaciales a escala más fina, por lo que iniciativas como el portal web FLORAND
(https://servicio.us.es/florand/), que
muestra la distribución de las plantas en cuadrículas de distinto tamaño (hasta
una escala de 5x5 km) y proporciona la información disponible para cada taxón,
son especialmente útiles. Estos instrumentos facilitarán el desarrollo de
modelos predictivos, identificando los factores implicados en la distribución
de especies (ej., Palmer et al. 2002) y son
fundamentales para la gestión de la conservación cuando los recursos son
limitados (Ferrier 2002).
El núcleo de las sierras
Béticas, con predominio de materiales calcáreos, pero también con importantes
afloramientos ácidos (p. ej., en las partes más elevadas de Sierra Nevada y
Sierra de los Filabres) y ultrabásicos (p. ej., en la Serranía de Ronda), incluye
las sierras más ricas en endemismos (Fig. 2). En las sierras Béticas de Algeciras y del Aljibe, las más
occidentales, la naturaleza ácida de sus suelos ha condicionado mucho su flora
y vegetación y, junto a sus características climáticas, han propiciado la
existencia de algunos endemismos singulares [por ejemplo, Bellis cordifolia (Kunze) Willk., Biscutella lyrata L., Carduus santacreui (Devesa y
Talavera) Devesa, Centaurea molesworthiae E. López, Devesa y García
Rojas] así como la pervivencia de algunos relictos de la flora terciaria. En
las sierras Béticas sudorientales (p. ej., Alhamilla, Cabo de Gata, Cabrera) es
la aridez del clima lo que condiciona la vegetación, a la vez que propicia la
existencia de endemismos singulares adaptados a las condiciones imperantes,
como Antirrhinum charidemi Lange. Entre las sierras calcáreas que
albergan mayor número de endemismos andaluces cabe destacar la Serranía de
Ronda, las sierras de Tejeda y de Almijara, las de Cazorla y Segura y, sobre
todo, Sierra Nevada ―calcárea en su tramo inferior y medio―, que alberga ella
sola más del 50% de la flora andaluza y la mayor concentración de endemismos
(más de 100) a nivel peninsular y europeo. En resumen, la flora de Andalucía y
en particular la de las sierras Béticas destaca en la Península Ibérica no solo
por su alta diversidad sino también por el alto número de endemismos que le son
propios.

Figura 2. Las sierras
Béticas albergan un elevado número de endemismos, entre los que destaca el
pinsapo (Abies pinsapo Boiss.), que forma masas forestales en la Serranía de
Ronda (Málaga). Foto: F.I. Pugnaire.
Figure
2. The Betic ranges are home to a high number of
endemisms, among which the Spanish fir (Abies pinsapo Boiss.) stands out,
forming forests in the Serranía de Ronda (Málaga). Photo credit: F.I.
Pugnaire.
Origen histórico de la diversidad: los registros
palinológicos
Desde una perspectiva temporal, se pueden definir cuatro
hitos cruciales en la evolución de la flora y vegetación de las sierras
Béticas. En primer lugar, el contacto mesozoico entre Eurasia y Norteamérica,
que en algunos puntos se prolongó hasta finales del Paleoceno, hace unos 60
millones de años, y que ha significado la existencia de un buen número de
géneros comunes entre Norteamérica y el Mediterráneo europeo (Carrión 2002). El segundo hito histórico ocurrió en el
Mioceno, un período que incluye fases con grandes áreas emergidas y estrecho
contacto ibero-africano alternando con otras en las que, por ejemplo, el actual
extremo sureste de la Península Ibérica vino a ser un mar salpicado de pequeñas
islas. Esta configuración geográfica indujo el aislamiento de numerosas
comunidades vegetales y, eventualmente, la formación de nuevas especies. El
tercer período de relevancia es el Plioceno, durante el cual se dieron crisis
climáticas episódicas, acentuándose los veranos cálidos y secos, la aridez
general y cierto enfriamiento episódico. Esta serie de procesos, que culminaría
con las denominadas "glaciaciones cuaternarias", suponen la
desaparición progresiva de especies termófilas del continente europeo y la
expansión de formaciones xerófilas. El cuarto hito en la configuración de la
vegetación mediterránea se relaciona con los cambios climáticos y
biogeográficos que tuvieron lugar en el Cuaternario (Carrión
et al. 2022b). Es precisamente ese momento el que definió la diversidad
vegetal actual de las sierras Béticas, sobre todo por la extraordinaria
supervivencia de taxones meso-termófilos, algunos de origen terciario, durante
las fases climáticas que suponen su extinción en otras regiones de Europa. En
las formaciones del Pleistoceno, probablemente en un marco espacial
relativamente reducido, coexistieron comunidades vegetales de afinidad
climática muy diversa, desde pinares de alta montaña hasta matorrales y
formaciones herbáceas termo-xerofíticas con elementos ibero-norteafricanos,
asociaciones de especies de ribera, bosques mixtos con abundancia de
planifolios y bosques dominados por quercíneas, típicos del ambiente
mediterráneo con sequía estival. Los pisos de vegetación debieron estar más
próximos entre sí que en la actualidad, y la dependencia del sustrato (y del
agua freática) debió ser muy marcada en las fases más áridas (Altolaguirre et al. 2019; Ochando et al. 2022).
En las sierras Béticas se observan pautas de respuesta al
cambio climático que pueden ocurrir en centurias, o incluso décadas, mostrando
una capacidad de las comunidades vegetales para desplazarse altitudinalmente
que es de importancia capital para evitar la extinción local y regional de
especies. Se ve bien en la Sierra de Segura y en Sierra Nevada (Carrión et al. 2001; Carrión
2002; Jiménez-Moreno et al. 2023),
donde los cambios de temperatura habrían inducido desplazamientos altitudinales
de los pisos de vegetación y, así, las fases de pinar en el oromediterráneo
coincidirían con las expansiones de bosques de robles y encinas en los pisos
supra- y meso-mediterráneo. Hay también evidencias de una aridificación
creciente que habría comenzado hace aproximadamente 5000 años.
Además, en algunas situaciones el fuego es el condicionante
primordial de la composición, estructura y respuesta de las comunidades
vegetales a los cambios ambientales, con independencia de que su magnitud
espacial y recurrencia estén o no determinadas por el régimen climático.
También el fuego y, más tarde, el pastoreo, aparecen como elementos
contingentes en la evolución de la vegetación durante la segunda mitad del
Holoceno en sierras como Baza o Gádor, donde hubo una elevada diversidad de
especies leñosas con bosques locales de pino (Pinus nigra subsp. salzmanni)
y roble (Quercus faginea Lam.), acompañados de especies planifolias como
alisos, fresnos o avellanos junto a numerosos elementos termófilos que
alcanzaban cotas superiores a las actuales (como Chamaerops L.,
Myrtus L., Olea L., Phillyrea L., o Pistacia L.).
El tipo forestal cambia a raíz de dos modificaciones importantes en la
frecuencia de incendios, primero hacia la dominancia de un tipo de Quercus
perennifolio y después hacia la instalación de un pinar abierto con mayor
abundancia de gramíneas y especies espinosas y una mayor presión de consumo por
herbívoros (Carrión et al. 2007). La acción del
hombre durante los últimos milenios es un elemento crítico de perturbación,
determinante de cambios en las especies dominantes, de la disminución de la
diversidad vegetal y de la cobertura arbórea (Carrión
2002).
Cabe señalar que la mayor parte de la información
paleobotánica sobre las sierras Béticas se basa en análisis polínicos y
antracológicos (de carbón), y en pocas ocasiones de restos vegetales (Carrión 2002; Carrión et
al. 2022a). La gran debilidad de estos estudios es la dificultad de
identificar las especies herbáceas, por lo que las estimas de
paleo-biodiversidad están sesgadas a favor de las especies leñosas y de
dispersión polínica por el viento. Algunos estudios en yacimientos
arqueológicos y en coprolitos corrigen parcialmente el sesgo hacia las especies
zoócoras, pero las especies herbáceas siguen infravaloradas ya que en el
registro fósil se limitan al nivel de familia, subfamilia o tribu.
Procesos evolutivos en los linajes de las sierras
Béticas
A nivel de especie, lo que cada una es hoy en día no es más
que una fotografía instantánea de su propia historia, consecuencia de cómo ha
evolucionado su linaje hasta el momento actual. Esta evolución se compone de
procesos que sólo podemos inferir utilizando las huellas que han dejado en su
biología (morfología, fisiología) y en sus genomas, así como en los fósiles.
Pero los fósiles son muy escasos en plantas y las huellas en los genomas muy
lábiles debido a su dinamismo a lo largo del tiempo. A pesar de ello, las
nuevas herramientas de secuenciación masiva son la mejor oportunidad que hemos
tenido nunca de acceder a la información que esconden los genomas sobre los
procesos evolutivos que han generado la diversidad actual (Pont et al. 2019).
La tasa de diversificación de especies refleja el balance
neto entre la tasa de especiación y la tasa de extinción. Cuanto mayor es la
primera y menor la segunda en un linaje o territorio, más ricos en especies
serán estos. Para explicar la riqueza en especies de un territorio,
tradicionalmente se ha hablado de dos modelos (Stebbins
1974). El modelo ‘cuna’ es aquel en el que muchas especies se han generado
en el territorio, mientras que en el modelo ‘museo’ la riqueza se debe a que
muchas especies que se han generado en otros territorios se han acumulado en
ese punto. La diversidad de especies y linajes en las sierras Béticas se debe a
una combinación favorable de estos dos procesos además de otros factores (Nieto Feliner 2014).
El efecto museo habría influido en la biodiversidad de las
sierras Béticas sobre todo a través de los refugios que proporcionó la región a
plantas sensibles al frío durante los períodos glaciares de los últimos 2.5
millones de años, como hemos comentado (Hewitt 2004).
Las plantas, aunque más lentamente que los animales, también buscaron su óptimo
climático migrando hacia latitudes más meridionales durante los máximos
glaciares. La Península Ibérica en su conjunto se estima que albergó múltiples
refugios de este tipo, lo mismo que las otras dos penínsulas del sur de Europa
(Médail y Diadema 2009; Nieto Feliner 2011), pero en Andalucía se
maximizó el efecto de refugio debido a su latitud y orografía. Esta última, la
orografía, explica cómo los períodos glaciares no sólo afectaron a las plantas
sensibles al frío. Las plantas alpinas siguieron una dinámica inversa, refugiándose
—y reduciendo sus áreas— en pisos altos de montaña durante los más cálidos
períodos interglaciares. Estos movimientos ayudan a entender que Sierra Nevada
tenga un elevadísimo porcentaje de especies endémicas (30 – 40%) en sus partes
más elevadas.
Otro factor coadyuvante a la riqueza de linajes béticos que
encajaría en el modelo de museo, y que también se traduce en dinamismo de las
áreas de distribución a lo largo del tiempo, es la ubicación de Andalucía en
una encrucijada biogeográfica. Ello ha permitido que la biodiversidad de las
sierras Béticas se enriqueciera también con especies africanas. En este
sentido, se ha demostrado que la región del Estrecho de Gibraltar, donde el
paso e intercambio de especies ibéricas y africanas es más fácil y ha sido más
importante, debe parte de su riqueza y singularidad botánica a dicho
intercambio y acumulación (Rodríguez-Sánchez
et al. 2008).
¿Cómo contribuyó el componente “cuna” a la biodiversidad de
las sierras Béticas? Esta región también fue muy fértil en cuanto a la
formación de nuevas especies.
La variada orografía, con abundantes sistemas montañosos
atravesados por importantes valles, proporcionó un paisaje en mosaico, con
abundancia de hábitats diferentes, más o menos aislados, en un espacio
reducido. Esto se aplica no solo a la situación actual sino también a
condiciones pretéritas. Por ejemplo, como se ha señalado arriba, durante el
Mioceno parte de las actuales sierras Béticas orientales fueron sistemas
insulares aislados por el mar. Esta estructura del paisaje es particularmente
propicia para que algunas de las poblaciones aisladas pudieran completar su
diferenciación hasta desembocar en una nueva especie. Como se ha indicado
anteriormente, la presencia de sustratos muy diferentes y algunos de ellos muy
selectivos para el crecimiento de las plantas, como yesos, dolomías o
peridotitas, es también un componente importante de este mosaico de paisaje. La
adaptación y el aislamiento de quienes sobrevivieron en ellos condujo a veces a
la formación de nuevas especies, que hoy vemos como endemismos estrictos de
tales sustratos. El paisaje en mosaico pudo favorecer la especiación
alopátrica, consecuencia de la acumulación de barreras reproductivas y
diferencias entre poblaciones aisladas. La riqueza de hábitats también fue un
caldo de cultivo para la especiación ecológica, que tiene lugar cuando la
adaptación a un ambiente diferente es la causa del aislamiento reproductivo
entre poblaciones que divergen (Thompson et al.
2005). Todos estos factores, actuando combinadamente, han favorecido que
las sierras bética Béticas representen un ejemplo sobresaliente de la riqueza
en endemismos de área reducida, que es característico de toda la Cuenca
Mediterránea (Thompson 2005).
La disponibilidad de refugios durante los períodos más
adversos del Pleistoceno no solo contribuyó a la preservación de especies que
desaparecieron en otras latitudes (Hewitt 2004; Nieto Feliner 2011). Adicionalmente, los refugios
béticos funcionaron como crisoles, enclaves donde se produjo el contacto
secundario de poblaciones que habían estado separadas geográficamente durante
los períodos interglaciares y no habían alcanzado aislamiento reproductivo
suficiente (Petit et al. 2003). Como resultado de
este contacto se produjeron procesos que pudieron incrementar la diversidad
genética, y con ello la supervivencia de las poblaciones, así como espolear la
diversificación. Por ejemplo, la hibridación entre poblaciones parcialmente diferenciadas
fue en algunos casos motor de adaptación o incluso de especiación (Gutiérrez-Larena et al. 2002; Marques et al. 2018). Esto último ocurrió, sobre
todo, cuando la hibridación fue acompañada de poliploidía (duplicación del
complemento cromosómico completo), ya que este mecanismo puede representar una
vía rápida a la formación de una nueva especie aislada, estabilizada genéticamente
y fértil (Soltis et al. 2015; Van de Peer et al. 2017).
Tal vez a caballo entre cuna y museo, la relativa
estabilidad ambiental, y específicamente climática, dentro de los refugios
probablemente contribuyó a mantener y enriquecer las interacciones ecológicas
con comunidades de polinizadores, dispersores, predadores, etc., lo cual pudo a
su vez favorecer la diversificación. En suma, desde una perspectiva histórica
aplicada a las especies y los linajes, las causas de que las sierras Béticas
sean un punto de elevada biodiversidad son probablemente una combinación favorable
de elementos abióticos y bióticos que maximizaron la preservación de especies,
de la propia región y de otras aledañas, y también la generación de nuevas
especies, unido todo ello a la importancia de procesos motores de
diversificación derivados de una dinámica biogeográfica muy activa durante los
últimos dos millones y medio de años.
Interacciones ecológicas que favorecen la diversidad
El potencial que las relaciones planta-animal, planta-planta
y planta-suelo tienen para la evolución y diversificación de las plantas ha
despertado curiosidad científica desde los tiempos de Darwin, y en las últimas
décadas ha recibido mucha atención (Herrera y
Pellmyr 2002; Austin y Ballaré 2014).
Hoy se reconoce que estas interacciones son fundamentales en la creación y
mantenimiento de la biodiversidad (Cavieres et al.
2014; Valiente-Banuet et al. 2015).
Las interacciones de las plantas con polinizadores, herbívoros y dispersantes
de semillas frecuentemente constituyen presiones selectivas para las plantas
capaces de provocar (i) cambio evolutivo (genético y fenotípico) en las
poblaciones, (ii) divergencia de caracteres y diferenciación genética entre
poblaciones sujetas a diferentes regímenes de selección, y (iii) especiación y
radiación adaptativa, a través de su influencia en procesos como el flujo
génico entre poblaciones y el aislamiento reproductivo entre especies
incipientes. A continuación, analizamos alguna de las interacciones más
importantes desde el punto de vista la diversidad vegetal.
Polinización y diversidad de plantas
En el caso concreto de las interacciones planta-insecto, una
de las más beneficiosas para ambos es la polinización, una interacción que ha
contribuido a la coevolución y diversificación morfológica de algunos grupos (Armbruster 2014) e influye sobre el ensamblaje de
las comunidades vegetales (Moreira-Hernández
y Muchhala 2019). En esta interacción se produce un intercambio de comida
por movimiento que favorece la reproducción de las plantas y el flujo de genes
entre sus poblaciones al tiempo que proporciona un alimento esencial para los
insectos en forma de néctar y polen. Este alimento condicionará la
supervivencia y fecundidad no solo de miles de especies de insectos sino
también de microbios especializados, que encuentran en el néctar su hábitat
ideal (Herrera et al. 2009). El efecto que estas
comunidades microbianas ejercen sobre las características del néctar afecta al
comportamiento de algunos polinizadores y puede tener consecuencias para la
calidad de la polinización y el flujo génico, particularmente en especies con
comunidades de polinización poco diversas (de Vega et
al. 2022).
Datos sobre polinización en sistemas naturales de la Sierra
de Cazorla (Fig. 3), una región que acumula más
conocimiento sobre estos procesos que ninguna otra en el Mediterráneo (Araque Jiménez 2016), muestran que la mayoría de
las plantas son polinizadas por comunidades de insectos que combinan en
distinta proporción escarabajos, moscas, mariposas e himenópteros, grupo en el
que se incluyen abejas, avispas y hormigas (Herrera
2019, 2020, 2021).
Podemos destacar que, aproximadamente, un tercio de las especies de abejas
presentes en la Península Ibérica están en la Sierra de Cazorla (Ortiz-Sánchez et al. 2023). La diversidad de
polinizadores mejora la calidad de la polinización de especies endémicas en
esta región y reduce sus limitantes para la reproducción, facilitando por tanto
la persistencia de sus poblaciones (Alonso et al.
2013).

Figura 3. El Parque
Natural Sierras de Cazorla, Segura y Las Villas, en la provincia de Jaén,
alberga un elevado número de endemismos y concentra el mayor conocimiento sobre
las interacciones de las plantas con herbívoros, polinizadores y dispersantes
de semillas de todo el Mediterráneo. Foto: F.I. Pugnaire.
Figure
3. The Sierras de Cazorla, Segura and Las Villas
Natural Park, in the province of Jaén, is home to a high number of endemisms
and concentrates the greatest knowledge on plant interactions with herbivores,
pollinators and seed dispersers throughout the Mediterranean. Photo
credit: F.I. Pugnaire.
El efecto de la herbivoría
Los efectos de insectos y vertebrados herbívoros sobre la
diversidad vegetal son sin duda múltiples y complejos en nuestra región. La
especialización de la mayoría de los insectos herbívoros, que ha contribuido
evolutivamente a la diversificación de las plantas (Herrera y Pellmyr 2002), dificulta enormemente
la generalización sobre los efectos directos e indirectos que larvas y adultos
de diferentes órdenes de insectos defoliadores, florívoros y consumidores de
frutos y semillas ejercen sobre las poblaciones de plantas (Myers y Safraz 2017). A modo de ejemplo, el
éxito de desarrollo de la procesionaria es desigual entre especies de pinos y
su impacto sobre los pinares dependerá fundamentalmente de la densidad y
estructura de los mismos (Hodar et al. 2002). Por
su parte, los grandes herbívoros proporcionan heterogeneidad al paisaje,
creando mosaicos de comunidades herbáceas y leñosas, y contribuyen a la
dispersión de semillas de muchas de las especies que consumen (Malo y Suárez 1995). Sin embargo, también afectan
drástica y negativamente a la reproducción y persistencia de muchas especies
leñosas (Zamora et al. 2008) como veremos con más
detalle en el apartado de amenazas a la diversidad.
Importancia de los dispersores de semillas
En el Mediterráneo, el 44% de las especies leñosas son de
fruto carnoso (Jordano 2014). Las aves frugívoras
modelan la vegetación en función de sus preferencias por uno u otro tipo de
frutos, en un juego que implica un reemplazamiento estacional de los grupos de
frugívoros que interactúan con comunidades vegetales de frutos carnosos en las
que los frutos disponibles también cambian estacionalmente (Herrera 1995). Así, entre las especies de aves con un
fuerte hábito frugívoro hay especies residentes, migrantes europeas
(típicamente invernantes) y migrantes subsaharianas (transitorias de
verano-otoño), que actúan complementariamente para facilitar la dispersión de
semillas a todo el conjunto de especies productoras de frutos de las sierras
Béticas y de la cuenca mediterránea (Herrera 1984).
Modificaciones de origen antrópico (por cambio climático, cambios de uso de la
tierra, o sobrecaza) de estos grupos de aves frugívoras tienen consecuencias
para la dispersión de semillas, y limitan que las plantas puedan desplazarse
hacia hábitats y climas más favorables "huyendo del nuevo escenario
climático" asistidas por los movimientos de las aves. Por tanto, cómo se
ensamblarán y quiénes integrarán las futuras comunidades forestales en las
sierras Béticas, y en muchas otras regiones del continente europeo, dependerá
de la estructura de la comunidad de aves frugívoras y de que se mantengan sus
interacciones con las plantas productoras de frutos (González-Varo et al. 2021; Tarifa et al. 2024).
Los microrganismos del suelo
Las plantas vasculares han sido consideradas a menudo como
organismos autónomos cuando, en realidad, albergan una comunidad muy diversa de
microorganismos que usualmente le aportan muchos beneficios, como una mayor
eficiencia fotosintética, una mejora en el uso de nutrientes, un aumento en el
desarrollo de raíces o protección frente a patógenos (Nordgaard et al. 2021). Esta
interacción planta-microrganismos del suelo es un componente importante en los
mecanismos que median la respuesta de las comunidades vegetales a los cambios
ambientales, que con frecuencia comportan procesos de especiación (Hewitt 2004). En la última década ha habido un aumento exponencial de
estudios centrados en las interacciones planta-suelo, que generalmente han
concluido que las comunidades de microorganismos del suelo determinan la
diversidad y composición de las comunidades vegetales (Van der Heijden et al. 2008). También hay evidencia de estos procesos en la región SE
peninsular, incluyendo las sierras Béticas y sus zonas más bajas, donde se ha
documentado que los microorganismos influyen en la sucesión de las comunidades
vegetales (Lozano et al.
2014), determinan el crecimiento y la
productividad de las plantas y sus interacciones (Rodríguez-Echeverría et
al. 2013; Hortal et al. 2015, 2017; Lozano et al. 2017), la abundancia de especies (Lozano
et al. 2020), la
disponibilidad y reciclaje de nutrientes (Martínez-García
et al. 2017), sobre
todo a través de descomposición de la
materia orgánica de las plantas (Pugnaire et al. 2023) y, en última instancia, modulan el funcionamiento de los ecosistemas (Lozano
et al. 2014; Pugnaire
et al. 2019). Todos estos efectos a nivel de comunidad pueden
resultar en procesos de especiación.
Los microorganismos del suelo tienen la capacidad de
modificar drásticamente factores como el tiempo de floración o las
características funcionales de las plantas (Lau y
Lennon 2011; Rodríguez-Echeverría et
al. 2013; Fitzpatrick et al. 2019).
Recíprocamente, la comunidad microbiana del suelo se ve afectada por la
diversidad de plantas y su variabilidad genética (Stultz
et al. 2009; Hortal et al. 2015). Por lo
tanto, es muy probable que relaciones funcionalmente importantes entre las
plantas y sus microbios asociados den como resultado una retroalimentación
eco-evolutiva (Angulo et al. 2022) que conduzca a
la especiación.
Biodiversidad amenazada
La gran diversidad de
plantas e interacciones biológicas que caracterizan de las sierras Béticas
está, sin embargo, amenazada a corto plazo. Las amenazas no difieren mucho de
lo que se ha identificado como los principales motores del cambio global que contribuyen
a la destrucción de hábitats naturales y pérdida de biodiversidad en las
últimas décadas: el cambio climático, los cambios de usos del suelo, incluyendo
la intensificación agraria y la urbanización, que conllevan la pérdida y
fragmentación de hábitats naturales, la deposición de nutrientes y las
invasiones biológicas (Sala et al. 2000; IPBES 2019). La mayoría de estos factores actúan tanto a
escala local como regional o global, y por su intensidad y velocidad algunos
tienen ya un efecto notable en la diversidad de las sierras Béticas.
El cambio climático
La crisis climática
y los riesgos derivados del calentamiento de la atmósfera son muy elevados. Por
ejemplo, la creciente aridificación en las sierras Béticas se está
intensificando como consecuencia de las elevadas temperaturas que se alcanzan
junto a la disminución e irregularidad de las precipitaciones, lo que da lugar
a que ecosistemas típicamente secos del Mediterráneo rebasen umbrales críticos,
pasando de bosques y matorrales arborescentes a estepas semiáridas, y de éstas
a zonas desérticas con escasa vegetación (Kéfi et al. 2007; Maestre
et al. 2022). Las nuevas
condiciones ambientales no sólo ponen a prueba la tolerancia al cambio de las
especies vegetales, sino que pueden alterar el balance de las interacciones
entre plantas, afectando, entre otros aspectos, al nicho de regeneración de
muchas especies. Las interacciones positivas como la facilitación
interespecífica, ampliamente documentada en algunas sierras Béticas, como
Sierra Nevada (Fig.
4), Filabres o Alhamilla, es
un importante mecanismo impulsor de la riqueza de especies a escala
macroecológica, que incrementa la diversidad de los ecosistemas con un efecto
que aumenta a medida que aumenta el estrés ambiental (Pugnaire et al.
2011; Schöb et al. 2013; Rey et al. 2016). Esto lo consigue expandiendo el nicho realizado de muchas especies de
plantas (O’Brien
et al. 2018). Además, la
facilitación es un mecanismo de salvaguardia de la biodiversidad ante el cambio
global (Cavieres
et al. 2014) que contribuye a
evitar la pérdida de diversidad florística y la desertificación. La facilitación
interespecífica parece que es también un factor muy importante como organizador
del uso de los polinizadores por parte de las comunidades de plantas, como se
ha mostrado recientemente en la sierra de Cazorla (Herrera 2021).

Figura 4. Arenaria tetraquetra subsp amabilis
(Bory) Lindberg es una subespecie endémica de Sierra Nevada que ilustra los procesos evolutivos que
hacen de las sierras Béticas un punto de diversidad vegetal de importancia
global. Foto: J. Vílchez.
Figure 4. Arenaria tetraquetra subsp amabilis (Bory) Lindberg is a subspecies
endemic to the Sierra Nevada range that illustrates the evolutionary processes
that make the Betic mountain ranges a hotspot of plant diversity. Photo
credit: J. Vílchez.
El cambio climático está afectando a comunidades
particularmente sensibles y ricas en endemismos, como son las regiones alpinas
de las sierras Béticas (Pugnaire et al. 2021).
Los aumentos de temperatura y la sequía influyen negativamente en la fisiología
de las plantas, causando un aumento de la respiración y limitando la fijación
de CO2 en un proceso que puede agotar las reservas de la planta y su
capacidad para afrontar eventos de herbivoría o perturbaciones como el fuego,
con consecuencias amenazantes para la supervivencia de las plantas y la
estructura de la comunidad (Pugnaire et al. 2020).
Como se ha comprobado en sierra Alhamilla, la supervivencia
de las plantas y su diversidad están fuerte y positivamente vinculadas a la
disponibilidad de agua, ya que a medida que desciende la capa freática en el
perfil del suelo las plantas incapaces de seguir en contacto con la zona húmeda
desaparecen (Padilla y Pugnaire 2007). En
las regiones alpinas, la humedad del suelo está disminuyendo de forma general
como consecuencia del cambio climático (Nogués
Bravo et al. 2008; Pauli et al. 2012; Sillmann et al. 2013; Lenoir y Svenning 2015), por lo que la
capacidad de los suelos para retener agua será un factor importante para la
persistencia de las plantas a medida que la aridificación progrese, ya que las
variables relacionadas con el balance hídrico se correlacionan con la riqueza
de especies en comunidades alpinas de todo el mundo (Cavieres
et al. 2014). En general, el cambio climático hará que los pisos de
vegetación se desplacen hacia arriba, dejando en las zonas más bajas, cálidas y
secas, una vegetación más típica de zonas áridas.
Además, el cambio
climático está afectando de muchas otras formas a las comunidades vegetales.
Por ejemplo, alterando el tamaño de los polinizadores y, quizá, su función.
Datos de los últimos 30 años muestran que el tamaño corporal de las abejas en
Cazorla ha disminuido, sobre todo en especies de mayor tamaño, sugiriendo que
los efectos del cambio climático sobre el éxito de polinización podrían derivar
no sólo de la pérdida de polinizadores sino también de la alteración de sus
patrones de movilidad o de la reducción de fertilidad derivada de un menor
tamaño en algunos de ellos (Herrera et al. 2023b). Por ejemplo, las especies del género Andrena,
que vuelan mayoritariamente a finales de invierno y principios de primavera,
tienen capacidad para alimentarse a una temperatura corporal mucho más baja que
la mayoría de las otras abejas, y rara vez se encuentran alimentándose en
flores por encima de 23°C (Herrera et al. 2023a). Por tanto, el período de tiempo adecuado para
la alimentación de estas abejas de mediano tamaño se verá reducido
substancialmente si continúan subiendo las temperaturas máximas, y muy
especialmente si aumenta la frecuencia de días cálidos, con temperaturas
superiores a 23-25°C. Esta circunstancia es particularmente preocupante, porque
buena parte de las especies de Andrena son especialistas y sólo colectan
polen de una determinada especie de planta o de un pequeño grupo de especies
emparentadas entre sí, por lo que algunas especies con floración temprana
podrían ver reducido substancialmente su éxito de polinización y su permanencia
en la comunidad a corto o medio plazo.
La actividad humana
En las sierras Béticas tienen particular impacto el cultivo
del olivar y la expansión de cultivos bajo plástico. El sur de España
constituye el área de mayor extensión mundial del cultivo del olivo, superando
en Andalucía los 1.5 millones de ha (Vilar y
Pereira 2018). La superficie actual es el resultado de un proceso de
expansión sobre zonas forestales a lo largo de décadas que continúa hasta hoy,
cuando se está extendiendo por zonas menos aptas para el cultivo, como las
áridas y semiáridas de Almería, Granada y Jaén, en las que causan erosión,
pérdida de suelos y sobreexplotación de acuíferos (Araque
Jiménez 2016; Martínez-Valderrama et
al. 2020). Datos recientes muestran grandes pérdidas de la diversidad
vegetal por la expansión del olivar, que llevan aparejadas otras pérdidas de
biodiversidad, como las que afectan a polinizadores (Martínez Núñez et al. 2019) y aves frugívoras
(Rey et al. 2021). La intensificación agrícola da
lugar a pérdidas en la diversidad y abundancia de aves frugívoras, lo que
disminuye su efectividad como dispersores de semillas y compromete la
regeneración natural de los remanentes de bosques y matorrales mediterráneos
que aún quedan en los paisajes agrícolas (Rey et al.
2021), así como su conectividad ecológica.
Como ya comentamos anteriormente, la sierras Béticas tienen
una larga historia de manejo silvopastoral, con influencias notables sobre la
diversidad vegetal. Por eso, el abandono de ciertas prácticas de ganadería
extensiva da lugar con frecuencia a procesos de matorralización, que implican
un riesgo añadido para algunas especies de plantas propias de la flora de alta
montaña a los derivados del incremento de temperaturas por el calentamiento
global. Sin embargo, hay que señalar también que el pastoreo afecta
negativamente a más de la mitad de las especies recogidas en la Lista Roja de
la Flora Vascular de Andalucía (Cabezudo et al.
2005), con diversos grados de amenaza en las categorías IUCN (Tabla 1). En esa obra, pastoreo se refiere sensu
lato a herbivoría por mamíferos grandes, tanto domésticos como silvestres.
A pesar de todas las limitaciones de este tipo de datos, los números sugieren
que la relación con los ungulados es un factor seguramente decisivo para el
futuro de las especies de flora más singulares de Andalucía. En algunos puntos
concretos el sobrepastoreo es una causa importante de desertificación (Martínez-Valderrama 2005), limitando la
recuperación de hábitats degradados. Efectos similares tiene la superpoblación
de especies de ungulados silvestres, algunas de ellas alóctonas, cuya densidad
poblacional no se controla y resulta excesiva en algunos espacios naturales.
Encontrar el equilibrio entre cargas ganaderas y de ungulados y conservación de
la flora de montaña, es todavía un reto (Zamora et
al. 2008).
Tabla 1. Número de especies
recogidas en la Lista Roja de la Flora Vascular de Andalucía, por categoría
IUCN para las que se señala el "Pastoreo" como una de las amenazas.
Pastoreo se refiere, sensu lato, a herbivoría por mamíferos grandes, tanto domésticos
como silvestres.
Table
1. Number of species included in the Red List of
the Vascular Flora of Andalusia, by IUCN category for which "Grazing"
is indicated as one of the threats. Grazing refers, sensu lato, to herbivory by
large mammals, both domestic and wild.
Otra amenaza que ha supuesto una grave pérdida de hábitats
naturales es la acelerada expansión del cultivo bajo plástico desde la década
de los 80 del pasado siglo, particularmente en la provincia de Almería. El
cultivo bajo plástico y la expansión urbanística han desplazado, por ejemplo, a
los matorrales arborescentes con azofaifo (Ziziphus lotus; Fig. 5) hasta casi su desaparición, quedando apenas
un 5% de la superficie existente hace 70 años. Además, las áreas que aún se
conservan sufren un severo proceso de degradación que afecta a las redes
tróficas, la diversidad de polinizadores (González-Robles
et al. 2020), la dispersión de semillas y la regeneración (Cancio et al. 2017; Rey et
al. 2018). Todo esto parece estar provocando el empobrecimiento genético de
algunas especies, limitando el flujo génico y la conectividad del hábitat
mediada por polinizadores (González-Robles et
al. 2020, 2021) y agravando los
problemas de conservación.

Figura 5. Fotografías
de un sistema de Ziziphus lotus (L.) Lam. bien conservado en la provincia de
Almería, con algunas especies representativas los principales grupos de
polinizadores. Foto: A. Gónzalez Robles.
Figure
5. Photographs of a well-preserved Ziziphus lotus
(L.) Lam. system in the province of Almería, with some representative species
of the main pollinator groups. Photo credit: A. González Robles.
Además, la reciente expansión de
plantas fotovoltaicas en terrenos de alto valor natural supone una nueva
amenaza para la biodiversidad, ya que frecuentemente implica la destrucción de
hábitats naturales y la fragmentación de poblaciones de flora y fauna,
introduciendo un gran número de elementos antropogénicos en una matriz de un
alto grado de naturalidad que afecta notablemente al paisaje (Serrano et al. 2020). Así, el despliegue de plantas
fotovoltaicas en ambientes como el campo de Tabernas, en Almería, especialmente
valioso en materia de biodiversidad, se ha hecho sin prever sus impactos reales
(Valera et al. 2022), en un proceso no
planificado y con efectos indeseables tanto para la flora como para la fauna,
que afecta especialmente a las aves esteparias (Herranz
y Suárez 1999; Avilés y Parejo 2004).
Mientras que mitigar los efectos directos del cambio
climático requiere un esfuerzo a medio y largo plazo de un gran número de
países, impactos del cambio de uso del suelo como los requeridos para
implementar la energía solar fotovoltaica de manera realmente sostenible son
más fáciles de controlar a nivel nacional. Lamentablemente, el actual
despliegue de energías renovables en el sureste peninsular y en buena parte de
España está lejos de criterios de sostenibilidad, provocando un gran impacto
negativo en especies y hábitats protegidos (Valera et
al. 2022).
En resumen, las sierras Béticas constituyen un laboratorio
único para investigar los mecanismos que contribuyen a una riqueza
sobresaliente de especies vegetales, desde procesos históricos y evolutivos a
interacciones ecológicas. Pero, al igual que innumerables sistemas alrededor
del planeta, estos hábitats están sometidos a importantes presiones ambientales
que amenazan su estabilidad e incluso su misma naturaleza, entre las que
destacan los cambios de uso del suelo y el cambio climático. El primero se puede
abordar si existe “voluntad política”, mediante legislación que aplique
criterios de sostenibilidad; el segundo se antoja más complicado y exige la
armonización de políticas energéticas de un elevado número de países,
frecuentemente con objetivos enfrentados.
Agradecimientos
Agradecemos al editor, Ignasi Bartomeus, por su comprensión
y comentarios, que han ayudado a enriquecer nuestros puntos de vista, y a
Francisco Valera sus comentarios sobre la expansión de plantas fotovoltaicas en
Almería. Este trabajo se ha llevado a cabo en el marco de Sumhal, un proyecto
financiado por el Ministerio de Ciencia e Innovación de España, a través de los
Fondos Europeos de Desarrollo Regional (FEDER) [SUMHAL, LIFEWATCH‐2019‐09‐CSIC‐4, POPE 2014‐2020].
Contribución de autores
Todos los autores contribuyeron igualmente a la escritura de
este artículo.
Referencias
Alonso, C.,
Navarro-Fernández, C.M., Arceo-Gómez, G., Meindl, G.A., Parra-Tabla, V.,
Ashman, T.-L. 2013. Among species differences in pollen
quality and quantity limitation: implications for endemics in biodiverse
hotspots. Annals of Botany 112: 1461-1469.
Altolaguirre, Y., Postigo-Mijarra, J.M., Barrón, E., Bruch, A., Carrión, J.S.,
Leroy, S. 2019. The ecological scenario of the earliest
humans in western Europe. Review of Palaeobotany and Palynology 260:
51-64.
Angulo, V., Beriot, N., Garcia‐Hernandez, E., Li, E.,
Masteling, R., Lau, J.A. 2022. Plant–microbe eco‐evolutionary
dynamics in a changing world. New Phytologist 234: 1919-1928.
Araque Jiménez, E. 2016. El
Parque Natural de las Sierras de Cazorla, Segura y Las Villas. Treinta años
después. Diputación Provincial de Jaén. Jaén, España.
Armbruster, W.S. 2014. Floral specialization and angiosperm diversity: phenotypic divergence,
fitness trade-offs and realized pollination accuracy. AoB Plants 6:
plu003.
Austin,
A.T., Ballaré, C.L. 2014. Plant interactions with
other organisms: molecules, ecology and evolution. New
Phytologist 204: 257-260.
Avilés, J.,
Parejo, D. 2004. Farming
practices and Roller Coracias garrulus conservation in south-west Spain. Bird
Conservation International 14: 173-181.
Blanca, G., Cueto, M.,
Martínez-Lirola, M.J., Molero-Mesa, J. 1998. Threatened
vascular flora of Sierra Nevada (southern Spain). Biological Conservation
85: 269-285.
Buira, A., Cabezas, F., Aedo,
C. 2020. Disentangling ecological traits related to plant
endemism, rarity and conservation status in the Iberian Peninsula. Biodiversity
and Conservation 29: 1937-1958.
Cabezudo, B., Talavera, S.,
Blanca, G., Salazar, C., Cueto, M., Valdés, B., Hernández Bermejo, J.E., et al.
2005. Lista roja de la flora vascular de Andalucía. Consejería de Medio
Ambiente, Junta de Andalucía, Sevilla, España. 126 p.
Cancio, I., González-Robles,
A., Bastida, J.M., Isla, J., Manzaneda, A.J., Salido, T., Rey, P.J. 2017. Landscape degradation affects red fox (Vulpes vulpes) diet
and its ecosystem services in the threatened Ziziphus lotus scrubland
habitats of semiarid Spain. Journal of Arid
Environments 145: 24-34.
Cañadas, E.M.,
Fenu, G., Peñas, J., Lorite, J., Mattana, E., Bacchetta, G. 2014. Hotspots within hotspots: Endemic plant richness, environmental
drivers, and implications for conservation. Biological Conservation 170:
282-291.
Carrión, J.S. 2002. Patterns and processes of Late Quaternary environmental
change in a montane region of southwestern Europe. Quaternary
Science Reviews 21: 2047-2066.
Carrión, J.S., Munuera, M., Dupré, M., Andrade, A. 2001. Abrupt vegetation changes in the Segura Mountains of southern Spain
during the Holocene. Journal of Ecology 89, 783-797.
Carrión, J.S., Fuentes, N.,
González Sampériz, P., Sánchez Quirante, L., Finlayson, J.C., Fernández, S.,
Andrade, A. 2007. Holocene environmental change in a montane
region of southern Europe with a long history of human settlement. Quaternary
Science Reviews 26: 1455-1475.
Carrión, J.S., Barrón
López, E., Postigo-Mijarra, J.M., Casas-Gallego, M., Munuera, M., Ochando, J.,
Jiménez-Moreno, G., et al. 2022a. Paleoflora y Paleovegetación Ibérica I:
Paleoceno-Plioceno. Ministerio de Ciencia e Innovación, Madrid, y Fundación
Séneca, Murcia, España.
Carrión, J.S., Ochando, J.,
Munuera, M., Casas-Gallego, M., Amorós, G. 2022b. Paleoflora y
Paleovegetación Ibérica II: Pleistoceno. Ministerio de Ciencia e
Innovación, Madrid, y Fundación Séneca, Murcia, España.
Cavieres L., Brooker, R.W., Butterfield, B.J., Cook, B., Kikvidze, Z.,
Lortie, C.J., Michalet, R., et al. 2014. Facilitative
plant interactions and climate simultaneously drive alpine plant diversity. Ecology
Letters 17: 193-202.
Cueto, M., Melendo, M., Giménez, E., Fuentes,
J., López-Carrique, E., Blanca, G. 2018. First updated checklist of
the vascular flora of Andalusia (S of Spain), one of the main biodiversity
centres in the Mediterranean Basin. Phytotaxa 339: 1-95.
de Vega, C., Albaladejo,
R.G., Álvarez-Pérez, S., Herrera, C.M. 2022. Contrasting
effects of nectar yeasts on the reproduction of mediterranean plant species. American
Journal of Botany 109: 393-405.
Devesa, J.,
Martinez-Sagarra, G. 2023. Plantas vasculares endémicas de Andalucía.
MG Marketing. Villa del Río, Córdoba, España. Disponible en: https://bibdigital.rjb.csic.es/idurl/1/1769339
Ferrier, S. 2002. Mapping spatial pattern in biodiversity for regional
conservation planning: where to from here? Systematic Biology 51:
331-363.
Fitzpatrick, C.R., Mustafa, Z., Viliunas, J. 2019. Soil microbes alter plant
fitness under competition and drought. Journal of Evolutionary Biology
32: 438-450.
González-Robles,
A., Manzaneda, A.J., Salido, T., Valera, F., García, C., Fernández-Ocaña, A.M.,
Rey, P.J. 2020. Spatial genetic structure of a keystone
long-lived semiarid shrub: historical effects prevail but do not cancel the
impact of recent severe habitat loss on genetic diversity. Conservation
Genetics 21: 853-867.
González‐Robles, A., García, C.,
Salido, T., Manzaneda, A.J., Rey, P.J. 2021. Extensive pollen‐mediated
gene flow across intensively managed landscapes in an insect‐pollinated
shrub native to semiarid habitats. Molecular Ecology 30:
3408-3421.
González-Varo, J.P.,
Rumeu, B., Albrecht, J., Arroyo, J.M., Bueno, R.S., Burgos, T., Silva, L.P., et
al. 2021. Limited potential for bird migration to disperse
plants to cooler latitudes. Nature 595: 75–79.
Gutiérrez Larena,
B., Fuertes Aguilar, J., Nieto Feliner, G. 2002. Glacial-induced
altitudinal migrations in Armeria (Plumbaginaceae) inferred from
patterns of chloroplast DNA haplotype sharing. Molecular Ecology
11: 1965-1974.
Herranz, J., Suárez, F.
1999. La ganga ibérica (Pterocles alchata) y la ganga ortega (Pterocles
orientalis) en España. Distribución, abundancia, biología y conservación.
Ministerio de Medio Ambiente, Organismo Autónomo Parques Nacionales, Madrid.
Herrera, C.M. 1984. A study of avian frugivores, bird-dispersed plants, and
their interaction in mediterranean scrublands. Ecological Monographs 54:
1–23.
Herrera, C.M. 1995. Plant-vertebrate dispersal systems in the
Mediterranean: ecological, evolutionary, and historical determinants. Annual
Review of Ecology and Systematics 26: 705–727.
Herrera, C.M. 2019. Complex long-term dynamics of pollinator abundance in
undisturbed Mediterranean montane habitats over two decades. Ecological
Monographs 89: e01338.
Herrera, C.M. 2020. Flower traits, habitat, and phylogeny as predictors of
pollinator service: a plant community perspective. Ecological Monographs
90: e01402.
Herrera, C.M. 2021. Unclusterable, underdispersed arrangement of
insect-pollinated plants in pollinator niche space. Ecology 102: e03327.
Herrera, C.M., Pellmyr, O. 2002. Plant-Animal Interactions. Blackwell Publishing. Oxford. UK.
Herrera, C.M., de Vega, C.,
Canto, A., Pozo, M. I. 2009. Yeasts in floral nectar: a
quantitative survey. Annals of Botany 1039: 1415-1423.
Herrera, C.M., Núñez, A., Aguado, L.O., Alonso, C. 2023a. Seasonality of pollinators in Mediterranean montane habitats:
cool-blooded bees for early-blooming plants. Ecological Monographs
93: e1570.
Herrera, C.M., Núñez
Carbajal, A., Valverde, F.J., Alonso, C. 2023b. Body mass
decline in a Mediterranean community of solitary bees supports the size
shrinking effect of climatic warming. Ecology 104: e4128.
Hewitt, G.M. 2004. Genetic consequences of climatic oscillations in the
Quaternary. Philosophical Transactions of the Royal Society B 359:
183-195.
Hódar, J.A., Zamora, R.,
Castro, J. 2002. Host utilisation by moth and larval survival of pine
processionary caterpillar Thaumetopoea pityocampa in relation
to food quality in three Pinus species. Ecological Entomology
27: 292-301.
Hortal S., Bastida, F.,
Moreno, J.L., Armas, C., García, C., Pugnaire, F.I. 2015. Benefactor
and allelopathic shrub species have different effects on the soil microbial
community along an environmental severity gradient. Soil Biology and
Biochemistry 88: 48-57.
Hortal, S., Lozano, Y.M., Bastida, F., Armas, C., Moreno, J.L., Garcia,
C., Pugnaire, F.I. 2017. Plant-plant competition outcomes are modulated by
plant effects on the soil bacterial community. Scientific Reports 7:
17756.
IPBES. 2019. Summary for policymakers of the global assessment report on
biodiversity and ecosystem services of the Intergovernmental Science-Policy
Platform on Biodiversity and Ecosystem Services. En: S.
Díaz, et al. (eds.). IPBES secretariat, Bonn, Germany.
IUCN. 2023. The IUCN Red List of Threatened Species. Version 2023-1.
https://www.iucnredlist.org. [Accessed on 10 October 2023].
Jiménez-Moreno, G.,
García-Alix, A., Ramos-Román, M.J., Camuera, J., Mesa-Fernández, M.,
Jiménez-Espejo, F., López-Blanco, C., et al. 2023. Laguna Seca
sediments reveal environmental and climate change during the latest Pleistocene
and Holocene in Sierra Nevada, southern Iberian Peninsula. Palaeogeography,
Palaeoclimatology, Palaeoecology 631: 111834.
Jordano, P. 2014. Fruits and Frugivory. En: Gallagher, R.S. (Ed.) Seeds: The
Ecology of Regeneration of Plant Communities, pp. 18–61. CABI,
Wallington, UK.
Junta de Andalucía 2012.
Decreto 23/2012, de 14 de febrero, por el que se regula la conservación y el
uso sostenible de la flora y la fauna silvestres y sus hábitats. Consejería de
Medio Ambiente. Parlamento de Andalucía. BOJA nº 60 de 27/03/2012,
pp. 114-208
Kéfi, S., Rietkerk, M., Alados,
C.L., Pueyo, Y., Papanastasis, V.P., Elaich, A., de Ruiter, P.C. 2007. Spatial vegetation patterns and imminent desertification in
Mediterranean arid ecosystems. Nature 449: 213-217.
Lau, J.A.,
Lennon, J.T. 2011. Evolutionary ecology of
plant-microbe interactions: soil microbial structure alters selection on plant
trait. New Phytologist 193: 215-224.
Lenoir,
J., Svenning, J.C. 2015. Climate-related range
shifts – a global multidimensional synthesis and new research directions.
Ecography 38: 15.
Lorite, J., Gomez, F., Mota,
J.F., Valle, F. 2007. Orophilous plant communities of Baetic
range in Andalusia (south-eastern Spain): priority altitudinal-islands for
conservation. Phytocoenologia 37: 625.
Lozano, Y.M., Hortal, S.,
Armas, C., Pugnaire, F.I. 2014. Interactions among soil,
plants, and microorganisms drive secondary succession in a dry environment. Soil Biology and Biochemistry 78:
298-306.
Lozano, Y.M., Hortal, S., Armas, C., Casanoves, F., Pugnaire, F.I. 2017. Disentangling above- and below-ground facilitation drivers in arid
environments: the role of soil microorganisms, soil properties and
microhabitat. New Phytologist 216: 1236-1246.
Lozano, Y.M., Hortal, S.,
Armas, C., Pugnaire, F.I. 2020. Complementarity in nurse plant
systems: soil drives community composition while microclimate enhances
productivity and diversity. Plant and Soil 450: 385-396.
Maestre, F.T., Le Bagousse-Pinguet, Y., Delgado-Baquerizo, M., Eldridge,
D.J., Saiz, H., Berdugo, M., et al. 2022. Grazing and ecosystem service
delivery in global drylands. Science 378: 915-920.
Malo, J.E.,
Suárez, F. 1995. Herbivorous
mammals as seed dispersers in a Mediterranean dehesa. Oecologia
104: 246–255
Marques, I., Loureiro, J.,
Draper, D., Castro, M., Castro, S. 2018. How much do we know
about the frequency of hybridisation and polyploidy in the Mediterranean
region? Plant Biology 20: 21-37.
Martínez-García,
L.B., De Deyn, G.B., Pugnaire, F.I., van der Heijden, M.G.A. 2017. Symbiotic soil fungi reduce nutrient losses due to increased
rainfall intensity. Global Change Biology 23:
5228-5236.
Martínez‐Núñez, C., Manzaneda, A.J.,
Lendínez, S., Pérez, A.J., Ruiz‐Valenzuela,
L., Rey, P.J. 2019. Interacting effects of landscape and
management on plant–solitary bee networks in olive orchards. Functional
Ecology 33: 2316-2326.
Martínez-Valderrama,
J. 2005. Estudio de la desertificación por sobrepastoreo mediante un modelo de
simulación dinámica. Tesis Doctoral, E.T.S.I. Agrónomos, UPM, Madrid, España.
Martínez-Valderrama,
J., Guirado, E., Maestre, F. 2020. Unraveling
misunderstandings about desertification: The paradoxical case of the
Tabernas-Sorbas Basin in Southeast Spain. Land 9: 269.
Médail, F., Diadema, K. 2009. Glacial refugia influence plant diversity
patterns in the Mediterranean basin. Journal of Biogeography 36:
1333-1345.
Médail, F.,
Quezel, P. 1997. Hot-spots analysis for
conservation of plant biodiversity in the Mediterranean Basin. Annals of the
Missouri Botanical Garden 84: 112-127.
Molina-Venegas, R., Aparicio, A., Lavergne, S., Arroyo, J. 2017. Climatic and topographical correlates of plant palaeo-and
neoendemism in a Mediterranean biodiversity hotspot. Annals of Botany
119: 229-238.
Moreira-Hernández, J.I., Muchhala, N. 2019. Importance of
pollinator-mediated interspecific pollen transfer for angiosperm evolution. Annual
Review of Ecology, Evolution and Systematics 50: 191-217.
Mota, J.F., Pérez‐García, F.J., Jiménez, M.L., Amate, J.J., Peñas, J. 2002. Phytogeographical
relationships among high mountain areas in the Baetic Ranges (South Spain). Global
Ecology and Biogeography 11: 497-504.
Myers, J.H.,
Sarfraz, R.M. 2017. Impacts of insect herbivores on
plant populations. Annual Review of Entomology 62: 207-230.
Nieto Feliner, G. 2011. Southern European glacial refugia: a tale of tales. Taxon
65: 365-372.
Nieto Feliner, G. 2014. Patterns and processes in plant phylogeography in the
Mediterranean basin. A review. Perspectives in Plant Ecology, Evolution
and Systematics 16: 265-278.
Nogués-Bravo, D., Araújo, M. B., Lasanta, T., Moreno, J.I.L. 2008. Climate change in Mediterranean mountains during the 21st century. AMBIO
37: 280-285.
Nordgaard, M., Mortensen, R. M. R., Kirk, N. K., Gallegos‐Monterrosa,
R., Kovács, Á.T. 2021. Deletion of Rap‐Phr systems in Bacillus subtilis
influences in vitro biofilm formation and plant root colonization. MicrobiologyOpen
10: e1212.
O’Brien, M.J., Armas, C.,
Rodríguez-Echeverría, S., Morillo, J.A., Martín-Usero, F., López-Escoriza, A.,
Aránega, D.J., et al. 2018. Mimicking a rainfall gradient to
test the role of soil microbiota for mediating plant species responses to drier
condition. Oikos 127: 1776-1786.
Ochando, J., Carrión, J.S.,
Altolaguirre, Y., Munuera, M., Amorós, G., Jiménez Moreno, G., Solano, J., et
al. 2022. Palynological investigations in the Orce
Archaeological Zone, Early Pleistocene of southern Spain. Review of
Palaeobotany and Palynology 304: 104725.
Ortiz-Sánchez, F.J., Valverde, F J., Núñez Carbajal, A., Alonso, C., Herrera,
C.M. 2023. Las abejas (Hymenoptera, Apoidea) de la Sierra de Cazorla
(España). Monografías SEA, Jaén.
Padilla
F.M., Pugnaire, F.I. 2007. Rooting
depth and soil moisture control Mediterranean woody seedling survival during
drought. Functional Ecology
21: 489-495.
Palmer, M. W., Earls, P. G., Hoagland, B. W., White, P. S., Wohlgemuth, T.
2002. Quantitative tools for perfecting species lists. Environmetrics
13: 121-137.
Pauli, H., Gottfried, M., Dullinger, S., Abdaladze, O., Akhalkatsi, M.,
et al. 2012. Recent plant diversity changes on Europe’s mountain summits. Science
336: 353-355.
Petit, R.J., Aguinagalde, I., de Beaulieu, J.-L., Bittkau, C., Brewer,
S., Cheddadi, R., Ennos, R., et al. 2003. Glacial refugia: hotspots but not
melting pots of genetic diversity. Science 300: 1563-1565.
Pont, C., Wagner, S., Kremer, A., Orlando, L., Plomion, C., Salse, J.
2019. Paleogenomics: reconstruction of plant evolutionary trajectories from
modern and ancient DNA. Genome Biology 20: 1-17.
Pugnaire, F.I., Armas, C.,
Maestre, F.T. 2011. Positive plant interactions in the Iberian
Southeast: mechanisms, environmental gradients, and ecosystem function. Journal
of Arid Environments 75: 1310-1320.
Pugnaire, F.I., Morillo, J.M., Peñuelas, J., Reich, P.B., Gaxiola, A.,
Bardgett, R.D., Wardle, D., et al. 2019. Climate change effects on plant-soil
feedbacks and consequences for biodiversity and functioning of terrestrial
ecosystems. Science Advances 5: aaz1834.
Pugnaire, F.I., Pistón, N., Macek, P., Schöb, C., Estruch, C., Armas, C.
2020. Warming enhances growth but does not affect plant
interactions in an alpine cushion species. Perspectives in Plant Ecology,
Evolution and Systematics 44: 125530.
Pugnaire, F.I., Losapio, G., Schöb, C. 2021. Species
interactions involving cushion plants in high-elevation environments under a
changing climate. Ecosistemas 30: 2186.
Pugnaire, F.I., Aares, K.H., Alifriqui, M., Bråthen, K.A., Kindler, C.,
Schöb, C., Manrique, E. 2023. Home-field advantage effects in litter
decomposition is largely linked to litter quality. Soil Biology and
Biochemistry 184: 109069.
Rey, P.J., Alcántara, J.M., Manzaneda, A.J., Sánchez‐Lafuente,
A.M. 2016. Facilitation contributes to Mediterranean
woody plant diversity but does not shape the diversity–productivity
relationship along aridity gradients. New Phytologist 211:
464-476.
Rey, P.J., Cancio, I.,
Manzaneda, A.J., González‐Robles,
A., Valera, F., Salido, T., Alcántara, J.M. 2018. Regeneration
of a keystone semiarid shrub over its range in Spain: habitat degradation
overrides the positive effects of plant–animal mutualisms. Plant Biology 20: 1083-1092.
Rey, P.J., Camacho, F.M., Tarifa, R., Martínez-Núñez, C., Salido, T.,
Pérez, A.J., García, D. 2021. Persistence of seed dispersal in agroecosystems:
effects of landscape modification and intensive soil management practices in
avian frugivores, frugivory and seed deposition in olive croplands. Frontiers in Ecology and Evolution 9:
782462.
Rodríguez-Echeverría, S., Armas, C., Pistón, N.,
Hortal, S., Pugnaire, F.I. 2013. A role for
below-ground biota in plant-plant facilitation. Journal of Ecology 101:
1420-1428.
Rodríguez-Sánchez, F., Pérez-Barrales, R., Ojeda, F., Vargas, P., Arroyo, J. 2008. The Strait of Gibraltar as a melting pot for plant biodiversity. Quaternary Science Reviews 27:
2100-2117.
Sala, O.E., Stuart Chapin III, F., Armesto, J.J., Berlow, E.,
Bloomfield, J., Dirzo, R., Huber-Sanwald, E., et al. 2000. Global biodiversity scenarios for the year 2100. Science 287,
1770-1774.
Schöb, C., Armas, C., Guler, M., Prieto, I., Pugnaire, F.I. 2013.
Variability in functional traits mediates plant interactions along stress
gradients. Journal of Ecology 101: 753-762.
Serrano, D., Margalida, A.,
Pérez-García, J.M., Juste, J., Traba, J., Valera, F., Carrete, M., et al. 2020.
Renewables in Spain threaten biodiversity. Science 370:
1282-1283.
Sillmann, J., Kharin, V.V., Zwiers, F.W., Zhang, X., Bronaugh, D. 2013.
Climate extremes indices in the CMIP5 multimodel ensemble: Part 2. Future
climate projections. Journal of Geophysical Research-Atmospheres 118:
2473-2493.
Soltis, P.S., Marchant, D.B., Van de Peer, Y., Soltis, D.E. 2015. Polyploidy and genome evolution in plants. Current Opinion in
Genetics and Development 35: 119-125.
Stebbins, G.L. 1974. Flowering plants: evolution above the species level.
Harvard University Press, Cambridge, MA.
Stultz, C.M., Whitham, T.G., Kennedy, K.J., Deckert, R., Gehring, C.A.
2009. Genetically-based susceptibility to herbivory influences the
ectomycorrhizal fungal communities of a foundation tree species. New
Phytologist 184: 657-667.
Tarifa, R., González-Varo,
J.P., Camacho, F.M., Pérez, A.J., Salido, T., Rey, P.J. 2024. Woodland
loss differently affects seed dispersal by resident and migratory avian
frugivores in olive grove-dominated landscapes. Agriculture, Ecosystems
& Environment 359: 108752.
Thompson, J.D. 2005. Plant evolution in the Mediterranean. Oxford
University Press, Oxford, UK.
Thompson, J.D., Lavergne, S., Affre, L., Gaudeul, M., Debussche, M. 2005.
Ecological differentiation of Mediterranean endemic plants. Taxon 5:
967-976
Valera, F., Bolonio, L., La Calle, A., Moreno, E. 2022. Deployment of
solar energy at the expense of conservation sensitive areas precludes its
classification as an environmentally sustainable activity. Land
11: 2330
Valiente-Banuet, A.,
Aizen, M.A., Alcántara, J.M., Arroyo, J., Cocucci, A., Galetti, M., García,
M.B., et al. 2015. Beyond species loss: the extinction of
ecological interactions in a changing world. Functional
Ecology 29: 299-307.
van der Heijden,
M.G., Bardgett, R.D., van Straalen, N.M. 2008. The unseen majority: soil
microbes as drivers of plant diversity and productivity in terrestrial
ecosystems. Ecology Letters 11: 296-310
Van der Peer,
Y., Mizrachi, E., Marchal, K. 2017. The evolutionary significance of polyploidy. Nature Reviews
Genetics 18: 411-424.
Vilar, J.,
Pereira J.E. 2018. International
Olive Growing. Worldwide Analysis and
Summary. Fundación Caja Rural de Jaén, Jaén, España.
Zamora R., García-Fayos, P.,
Gómez-Aparicio, L. 2008. Las interacciones planta-planta y planta animal en el
contexto de la sucesión ecológica. En: Valladares, F. (Ed.), Ecología del
bosque mediterráneo en un mundo cambiante (Segunda edición), pp. 373-396. Ministerio de Medio Ambiente. EGRAF, Madrid, España.
![]() , Montserrat Arista2
, Montserrat Arista2 ![]() , José S. Carrión3
, José S. Carrión3 ![]() , Juan A. Devesa4
, Juan A. Devesa4 ![]() , Carlos M. Herrera5
, Carlos M. Herrera5 ![]() , Gonzalo Nieto Feliner6
, Gonzalo Nieto Feliner6 ![]() , Pedro J. Rey7
, Pedro J. Rey7 ![]() , Conchita Alonso5
, Conchita Alonso5 ![]() ,
, 



