Introducción
La fijación del N atmosférico (N2) a
partir de actividades humanas se ha incrementado abruptamente desde la segunda
mitad del siglo XX (Galloway et al. 2004). A los 90 Tg N año-1
que se fijan de manera natural se suman otros 93 Tg N año-1, resultado
de actividades como la síntesis de fertilizantes nitrogenados, el cultivo de
plantas fijadoras de N y la quema de combustibles fósiles y biomasa, y se
espera que alcanzarán 189 Tg N año-1 a mediados del siglo XXI (Fig. 1, Galloway
et al. 2004).
Aunque el N es un nutriente esencial para el desarrollo de los seres vivos, tal
aumento ha alterado el adecuado funcionamiento de los ecosistemas (Aber et al. 1989; Galloway
et al. 2003) y es responsable de la pérdida de biodiversidad, de
cambio global y tiene consecuencias negativas al bienestar humano (Sala et al. 2000; Townsend
et al. 2003; Steffen et al. 2015). Por ejemplo, formas
reactivas de N (Nr), como los óxidos de N (NO, NO2), son
responsables de la lluvia ácida y precursores de ozono troposférico,
contaminantes atmosféricos relacionados con problemas respiratorios en humanos
y de pérdida de productividad en cultivos (Vitousek et al. 1997; Crutzen y Günter 2016; de
Vries 2021). Por su parte, los nitratos (NO3-) y
nitritos (NO2-) se pierden fácilmente con la escorrentía,
lo que lleva a problemas de eutrofización de cuerpos de agua e intoxicación del
ganado y humanos por su consumo (Galloway et al. 2003; WHO
2011). Las
formas reducidas, como el amoniaco (NH3 ) y amonio (NH4+),
causan acidez en cuerpos de agua y suelo, además de contribuir al material
particulado que ocasiona problemas respiratorios, de
regulación de la insulina y desordenes neurológicos (WHO 2003; Eldor 2007; Adlimoghaddam et al. 2016; Liu et al. 2020; de Vries
2021). También, en algunos procesos abióticos en la atmósfera e
intermediados por actividad microbiana se produce N2O (Eldor 2007; de Vries 2021).
Aunque este gas apenas representa el 6% de los gases de efecto invernadero, su
capacidad de calentamiento es 265 veces superior a la del CO2 y
persiste en la atmósfera largo tiempo, unos120 años (IPCC 2013).
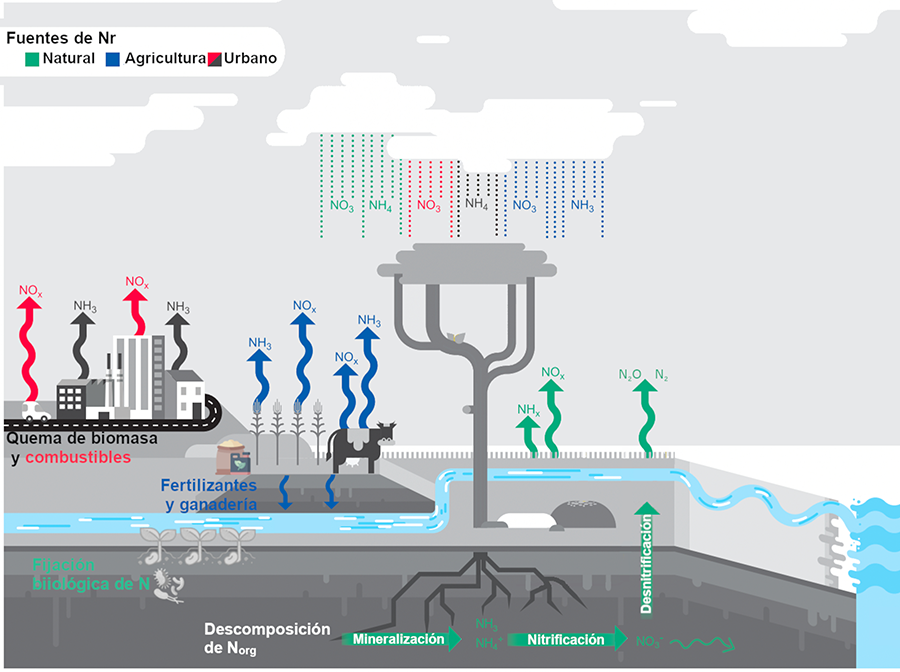
Figura 1. Procesos clave del ciclo
biogeoquímico del N. Principales fuentes de Nr y procesos que lo regresan a la
atmósfera como N2.
Las principales fuentes de Nr antrópico son el proceso Haber-Bosh para la
producción de fertilizantes nitrogenados, actividades agropecuarias, la siembra
de cultivos con fijadoras de N y la quema de combustibles fósiles y de biomasa (Galloway et al. 2004). Tales actividades
emiten formas reactivas de N, principalmente NOx y NH3, que se volatilizan a la
atmósfera para después depositarse por medio de la gravedad o precipitación
(depósito de N seco y húmedo, respectivamente; Pineda y Venegas 2008; Martínez et al. 2021a). La descomposición de
biomasa en el suelo también emite formas reactivas que se volatilizan a la
atmósfera, son producidas por la actividad microbiana (flechas verdes) y pueden
ser inmovilizadas o lixiviarse junto al Nr que se deposita (NO3- y NO2-) y llegar a ecosistemas acuáticos (Eldor 2007; Martínez
et al. 2021a).
Modificado de Díaz-Álvarez
et al. (2018).
Figure
1. Key processes of the nitrogen biogeochemical
cycle. Major sources of reactive nitrogen (Nr) and processes that return it to
the atmosphere as N2. The primary anthropogenic sources of Nr
include the Haber-Bosh process for N nitrogen fertilizer production, cattle
husbandry, the cultivation of N-fixing crops, and the combustion of fossil
fuels and biomass (Galloway
et al. 2004). These
activities release the nitrogen reactive forms, primarily as NOx and
NH3, which volatilize into the atmosphere and subsequently deposit
by gravity or precipitation (dry vs. wet N deposition, respectively; Pineda y Venegas 2008; Martínez
et al. 2021a). Biomass
decomposition in the soil also emits Nr, produced by microbial activity (green
arrows) and can be immobilized or leached alongside the deposited NO3-
and NO2-, eventually reaching aquatic ecosystems (Eldor 2007; Martínez et al.
2021a). Modified from Díaz-Álvarez et al. (2018).
Debido a los altos costos de operación de los sistemas
electroquímicos de monitoreo del depósito de formas reactivas de N, se puede
echar mano de organismos autótrofos, como líquenes, briofitas y plantas
vasculares, que asimilan NH4+ y NO3-,
que son precisamente las formas predominantes del depósito de N (Varela et al. 2017; de
Vries 2021; Martínez et al. 2021a).
El uso de estos organismos como biomonitores permite obtener información sobre
la calidad del ambiente a partir de sus respuestas fisiológicas o morfológicas
al contaminante de interés (Markert et al. 2003; Forbes
et al. 2015; AL-Alam et al. 2019).
Por ejemplo, con el contenido de N en especies de briofitas es posible estimar
el aporte de N atmosférico (Salemaa et al. 2008; Xiao
et al. 2011; Felix
et al. 2016) o identificar las fuentes predominantes de Nr con la firma
isotópica del N (δ15N) de sus tejidos (Ammann et al. 1999; Padgett
et al. 2009; Díaz-Álvarez et al.
2018).
Las áreas urbanas concentran una gran
cantidad de actividades que emiten contaminantes
nitrogenados (Galloway et al. 2004; Foley et al.
2005; de Vries 2021). Aunque las emisiones de N pueden
desplazarse a sitios muy alejados, el depósito de N en zonas urbanas es el
doble que en zonas rurales, lo que hace relevante el
monitoreo en tales sitios (Decina
et al. 2020). Sin
embargo, el desarrollo y uso de biomonitores en ambientes urbanos puede
ser difícil debido a que el ambiente construido de las ciudades genera
condiciones adversas para los organismos (Czaja et al.
2020; Martínez et al. 2021b). Por
ejemplo, la radiación que reciben las plantas en estos sitios
es alta, debido a los sitios desprovistos de vegetación y la radiación
reflejada por los materiales de construcciones (Czaja et al.
2020). También, en sitios
pavimentados, la temperatura puede aumentar alrededor de 10°C con respecto a
áreas sombreadas, generando el efecto de isla de calor, de mayor evaporación,
de poca infiltración de agua y, por tanto, de condiciones hídricas restrictivas
(Yang et al.
2016; Czaja et al. 2020). Además, la presencia de contaminantes
derivados de las actividades antrópicas es alta, como metales pesados y el Nr
abundante, aunque algunos son nutrientes, son tóxicos bajo alta disponibilidad (Nagajyoti
et al. 2010; Douglas et al. 2011; Ashraf y Harris 2013; Czaja et al.
2020; Zandalinas y Mittler 2022).
Las malezas se encuentran entre las
especies de plantas que crecen espontáneamente en ambientes modificados
fuertemente por la actividad humana y son capaces de tolerar las condiciones
ambientales adversas de las ciudades (Vibrans 2014). De hecho, estas plantas suelen proliferar durante los procesos de
urbanización, sustituyendo en algunos casos especies nativas (McKinney 2006; Šilc 2015; Martínez et al. 2021b). Dado que muchas de ellas tienen amplia distribución y son
abundantes en ambientes urbanos, podrían ser adecuadas para el biomonitoreo de
la contaminación (Markert
et al. 2003; Sutton et al. 2004; González et al. 2014). En esta revisión primero abordamos los
fundamentos fisiológicos necesarios para la selección de los organismos
tolerantes al exceso de N y las variables fisiológicas indicadoras de la
disponibilidad de N. Posteriormente destacamos el potencial de las malezas como
biomonitores del depósito de N en ambientes urbanos.
Fundamentos ecofisiológicos
Las plantas adquieren formas inorgánicas de
Nr, como NO3- y NH4+, y las
integran a su metabolismo formando compuestos como ácidos nucleicos, enzimas y
otras proteínas (Fig. 2; Marschner 2012). Estas dos formas reactivas de N suelen
ser abundantes en el depósito de N atmosférico, lo que genera un efecto
fertilizante (de Vries 2021). No obstante, su exceso puede provocar
estrés fisiológico, lo que afecta el desempeño y compromete la sobrevivencia de
las plantas (Aber et al. 1989; Stevens
et al. 2011; Tian et al. 2016). La
evaluación de estos efectos de fertilización y de estrés puede ayudar a
estimar la disponibilidad de Nr en el ambiente y la tolerancia
a dicho contaminante (Markert et al. 2003).
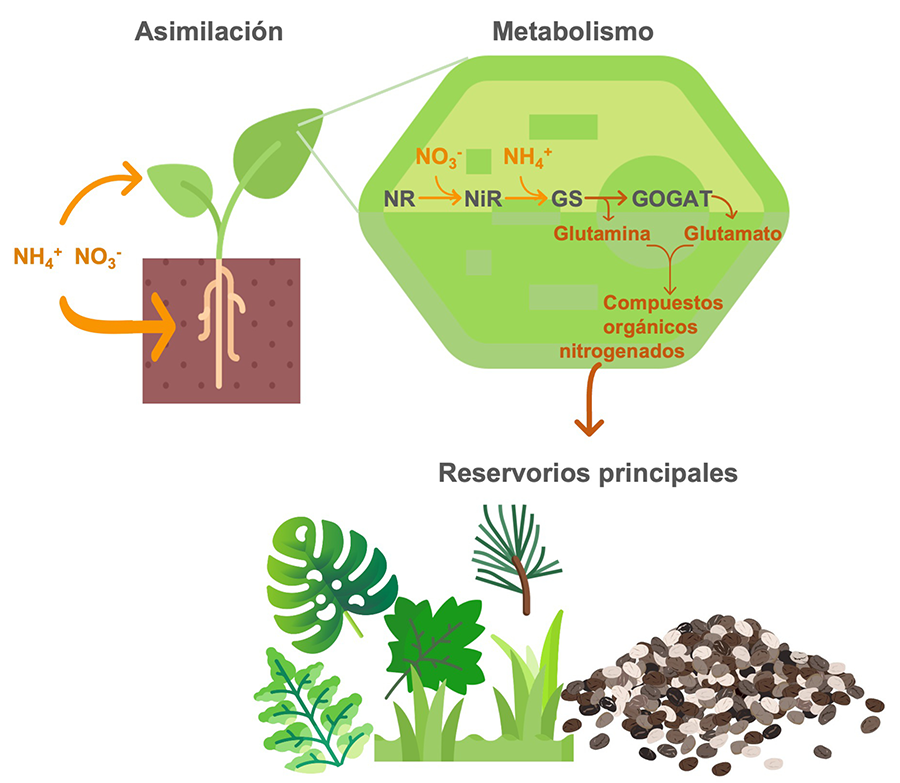
Figura
2. Metabolismo
del nitrógeno en plantas. La asimilación de nitrógeno sucede en las hojas y,
predominantemente, en la raíz. El nitrógeno adquirido es transportado a las
hojas donde es integrado a compuestos orgánicos mediante la acción de las
enzimas nitrato reductasa (NR), nitrito reductasa (NiR), glutamina sintetasa
(GS) y glutamato sintasa (GOGAT). Las hojas y las semillas, aunque en menor
medida, son los principales reservorios de nitrógeno en las plantas.
Figure 2. Nitrogen metabolism in
plants. Nitrogen assimilation occurs in the leaves and predominantly in the
root. The acquired nitrogen is transported to the leaves where it is integrated
into organic compounds through the action of nitrate reductase (NR), nitrite
reductase (NiR), glutamine synthetase (GS), and glutamate synthase (GOGAT)
enzymes. The leaves and seeds, to a lesser extent, are the main nitrogen
reservoirs in plants.
Contenido de N total
Entre las variables de interés para el
biomonitoreo se encuentra el nivel de N en la planta, ya que puede ser almacenado en las vacuolas, ser parte de
proteínas estructurales o de enzimas, etc., lo que lleva a un aumento del
contenido total de N, generalmente medido como
porcentaje del peso seco (N%) en los tejidos vegetales (Azcón-Bieto
y Talón 2008; Tegeder y
Masclaux-Daubresse 2018). Este aumento de N suele estar acompañado por incrementos en la
producción de biomasa, por ende, puede ser útil cuantificar el tamaño de
órganos (hojas), contenido de clorofilas y proteínas (González
et al. 1998; Bassi et al. 2018; Izquieta-Rojano et al.
2018; Piazzetta et al. 2019). Se estima que entre 30 y 40% del N asimilado se asigna al aparato
fotosintético, por lo que el contenido de clorofila y
proteínas como la RuBisCO también pueden ser indicadores del contenido de N en
las plantas (Meinzer y Zhu
1998; Arróniz-Crespo et al. 2008; Azcón-Bieto y Talón 2008; Bassi et al.
2018; Izquieta-Rojano et al. 2018; Piazzetta et al. 2019).
Actividades enzimáticas
La medición de la actividad de
diversas enzimas relacionadas con el metabolismo del N también
puede ser útil en el biomonitoreo del depósito de N (Martínez
et al. 2021a). Después de adquirir N en
formas inorgánicas, el NO3- es reducido hasta NH4+
para ser integrado a esqueletos orgánicos de C (Tegeder
y Masclaux-Daubresse 2018). La enzima nitrato
reductasa (NR) cataliza el primer paso en la reducción del N,
reduce el NO3-
a NO2- con la energía aportada
por la fotosíntesis, su transcripción y actividad son inducidas por su
sustrato, el NO3- (Hoff et al.
1992; Azcón-Bieto y Talón 2008; Tegeder y
Masclaux-Daubresse 2018). Esta enzima se
encuentra en el citosol, con actividad tanto en la raíz como en las hojas,
siendo la actividad predominante en este último sitio (Srivastava 1980; Kaiser y
Lewis 1984; Hoff et al. 1992; Azcón-Bieto y Talón 2008).
La segunda enzima en el metabolismo del N es la nitrito
reductasa (NiR). Ubicada en los cloroplastos y plastidios, se encarga de
reducir el NO2- a NH4+ (Azcón-Bieto
y Talón 2008).
La transcripción y actividad de la NiR son inducidas por el NO3-
y NO2- y dependen igualmente de
la energía proveniente de la fotosíntesis (Azcón-Bieto
y Talón 2008).
El NH4+ adquirido de manera
directa del ambiente como el reducido por la NR y NiR, es integrado a
esqueletos de C por la enzima glutamina sintetasa (Azcón-Bieto
y Talón 2008).
Dicha enzima, que se localiza en el cloroplasto y algunas isomorfas en el
citosol, inducible por el NO3-, NO2- y NH4+ (Azcón-Bieto
y Talón 2008).
Estas tres enzimas incorporan N inorgánico al componente biótico del ciclo del
N, sus actividades pueden ser indicadores de la disponibilidad de N en el
ambiente (Martínez
et al. 2021a).
La actividad de la enzima fosfomonoesterasa
(PME) también es usada como indicador del incremento de N (Johnson
et al. 1999; Arróniz-Crespo et al. 2008). Esta enzima rompe el enlace éster de
grupos fosfato, actividad que incrementa bajo deficiencia de fósforo (Arróniz-Crespo
et al. 2008; Díaz-Álvarez et al. 2019). Dado que en las ciudades aumenta el Nr
disponible, se incrementa la actividad de la PME para movilizar P, como se ha
documentado en briofitas y a nivel de rizosfera (Godavari
et al. 1976; Arróniz-Crespo et al. 2008; Png et al.
2017; Díaz-Álvarez et al. 2019).
Isotopos estables del N
Los isótopos estables del N han mostrado
ser una herramienta útil para identificar las fuentes de Nr (Dawson
et al. 2002; Santiago et al. 2005; Díaz-Álvarez et al. 2018). Específicamente, se han inferido las fuentes predominantes de Nr a
partir de la señal isotópica de los tejidos de árboles, epifitas vasculares,
briofitas y gramíneas, la cual se corresponde con las medidas hechas con
colectores químicos de depósito de N (Elliott
et al. 2007; Díaz-Álvarez et al. 2018; Cobley y
Pataki 2019). Igualmente,
se han analizado los cambios en el aporte de las fuentes de Nr a través del
tiempo, comparando el δ15N de organismos herborizados con muestras
posteriores (Peñuelas y
Filella 2001; Stewart et al. 2002; Díaz-Álvarez et al. 2018).
Mecanismos de estrés
Los síntomas
de toxicidad por el incremento de Nr se han documentado a partir de tasas de
depósito de N de 10 Kg de N ha-1 año-1, en algunas
especies de briofitas y líquenes, mientras que en las plantas vasculares sufren
daño desde los 20 Kg de N ha-1 año-1 (Arróniz-Crespo et al. 2008; Varela et al. 2017; Martínez
y de la Barrera 2021). El descenso del desempeño de las
plantas expuestas a exceso de N se atribuye en mayor medida a la adquisición de las formas reducidas de N (Janga y Raghuram 2015). El NH3
y NH4+ aprovechan la menor especificidad de otros
transportadores, como acuaporinas y los transportadores de Ca2+
y K+ y pueden acumularse en las células si no son
integrados a esqueletos de C (Britto
y Kronzucker 2002; Marschner
2012; Janga
y Raghuram 2015). Esto podría disminuir el pH en el interior de la
célula, conduciendo a un gran gasto energético para sacar el NH4+
y mantener estable el pH de los compartimentos celulares (Kronzucker et al. 2001; Britto
y Kronzucker 2002). En cuanto a formas oxidadas, se ha documentado
que se reduce la eficiencia fotosintética bajo tratamientos de fumigación con
NO2, además de descenso de la conductancia estomática y daños a la
cutícula donde se crean poros a través de los que el Nr pueden seguir entrando (Wang et al. 2019).
Dichos efectos también han sido adjudicados a la competencia por NADPH entre la
reducción de nitrato a nitrito y la asimilación de carbono, como al incremento
en especies reactivas de oxígeno y nitrógeno (Wang et al. 2019).
El incremento del depósito de N
atmosférico puede elevar la acidez del suelo (van den Berg
et al. 2005; Tian y Niu 2015; Tian et al.
2016; de Vries 2021). El NO, subproducto de la combustión o
resultado de la fijación fotoquímica, se transforma de manera rápida en NO2,
el cual reacciona con componentes suspendidos en la atmósfera, como los
radicales OH y agua para formar el HNO3 (Crutzen y
Günter 2016). Este es uno
de los componentes de la lluvia ácida (Aber et al.
1989; de Vries 2021). El
gas NH3, emitido por actividades antrópicas o fijación fotoquímica,
puede comportarse como una base al aceptar H+, pero al precipitarse
solo o junto a otros componentes en la atmósfera incrementa la nitrificación,
lo que provoca descensos del pH en el suelo (van den Berg
et al. 2005; Eldor 2007).
Las condiciones ácidas en el suelo provocan
la lixiviación de algunos cationes de importancia biológica (Ca2+, K+,
Mg2+), lo que restringe su adquisición y puede llevar a un
desbalance nutricional a las plantas (DeHayes
et al. 1999; van den Berg et al. 2005; Horswill
et al. 2008). Además, algunos metales pesados que se solubilizan en
condiciones ácidas (Al3+, Mn2+)
pueden reducir la toma de cationes con valencia,Ca2+, K+ y causar pobre desarrollo
radicular y biomasa (van den Berg
et al. 2005; Kogelmann y Sharpe 2006; Poschenrieder
et al. 2008; Tian y Niu 2015; Tian et al. 2016). Por lo que cuantificar los cambios en las
relaciones del N con otros elementos (Ca, K, P), puede
ser un indicador también del exceso de Nr en el ambiente (Roem y
Berendse 2000; Arróniz-Crespo
et al. 2008; Johansson et al. 2010; Izquieta-Rojano
et al. 2018; Díaz-Álvarez et al. 2020).
Evaluar el daño fisiológico es útil
para determinar la tolerancia al exceso de N en biomonitores
potenciales (Markert
et al. 2003; Kapoor et al. 2019). Una de las variables fisiológicas que
pueden identificar el estrés por exceso de N es la producción especies
reactivas de oxígeno (Kapoor
et al. 2019). Dicho
estrés oxidativo puede ser desencadenado por los NOx y
algunos moléculas y cationes que se incrementan junto al Nr, como O3,
Mn2+ y Al3+ (Apel y Hirt 2004; Demidchik
2015; Kapoor et al. 2019;
Schneider et al. 2019; Wang et al. 2019).
Por ejemplo, las enzimas de acción antioxidante se
pueden incrementar bajo toxicidad por N, como la actividad de la enzima
superóxido dismutasa (Demidchik 2015; Izquieta-Rojano
et al. 2018). También es de utilidad cuantificar
el daño a las membranas celulares, el cual se produce cuando
la concentración de especies reactivas sobrepasa la de los antioxidantes (Arróniz-Crespo
et al. 2008). En este caso, el malondialdehído, subproducto de
la peroxidación lipídica, se puede incrementar, mientras que las
concentraciones de K pueden descender, indicando el daño a membranas (Arróniz-Crespo et al. 2008; Kong et al.
2016; Izquieta-Rojano
et al. 2018; Schneider et al. 2019). También se puede
determinar la actividad de enzimas oxidantes, como la peroxidasa
y la polifenol oxidasa, que tiende a incrementarse bajo
condiciones en las que la planta comienza a
experimentar estrés (Kapoor
et al. 2013).
La fotosíntesis es otro de los procesos perturbados por el exceso de
N reactivo (Bassi et al.
2018). Primero puede observarse
un incremento de la fotosíntesis debido al efecto de fertilización, dado que se
puede incrementar el contenido de clorofilas y de la enzima RuBisCO (Arróniz-Crespo et al. 2008; Bassi et al.
2018). Sin embargo, en condiciones de exceso
de N para la planta, desciende la tasa fotosintética, indicando
estrés en las plantas y el inicio de la toxicidad (Arróniz-Crespo et al. 2008). Por ejemplo, la
fluorescencia de la clorofila a se puede incrementar bajo estrés
reflejando valores bajos del rendimiento cuántico máximo del fotosistema II
(PSII; Fv/Fm), así como del rendimiento cuántico efectivo
del PSII (ɸPSII), los cuales estiman la luz aprovechada
fotoquimícamente, indicando daños al fotosistema (González
et al. 1998; Arróniz-Crespo
et al. 2008; Ashraf y Harris 2013). Además, el exceso
de N puede afectar las relaciones de la
clorofila y los pigmentos accesorios, que muestran el ajuste de los organismos
para amortiguar el daño fisiológico e inicio de la degradación de pigmentos (Arróniz-Crespo et al. 2008; Ashraf y
Harris 2013).
Por ejemplo, la clorofila b puede ser transformada en clorofila a
bajo estrés, lo que incrementa la relación clorofila a/b,
o bien, la clorofila puede ser degradada a feofitina a e incrementar su
relación con la clorofila a (González et al. 1998; Arróniz-Crespo et al. 2008; Ashraf y
Harris 2013).
Asimismo, los carotenos ejercen un efecto protector incrementándose en los
tejidos cuando el amonio es alto en suelos (Arróniz-Crespo et al. 2008; Ochoa-Hueso
et al. 2014). Así que, plantas con tolerancia a
suelos ricos en NH4+ suelen mostrar relaciones altas de
los carotenos con la clorofila y otros pigmentos accesorios, como la
neoxantina+luteina, especialmente cuando el Mn se comienza a incrementar (Arróniz-Crespo et al. 2008; Ochoa-Hueso
et al. 2014).
Malezas biomonitoras
Las malezas son capaces de beneficiarse con
la actividad humana y suelen ser organismos abundantes y a veces de los pocos
que logran prosperar en ambientes urbanizados (Hanan-Alipi
y Vibrans 2015). Además, cumplen
con los requisitos que se buscan en un biomonitor en ambientes urbanizados,
incluyendo que presentan poca movilidad, amplia distribución, son abundantes en
las zonas de interés y toleran el disturbio (Martínez et al. 2021a). La proximidad a
la actividad humana, que conlleva al transporte accidental de las malezas, ha
incrementado sus áreas de distribución, siendo algunas cosmopolitas (Pyšek et al.
2004; Villaseñor y
Espinosa-Garcia 2004; Martínez-De La Cruz
et al. 2015; Espinosa-García et al.
2019; Martínez et al. 2021b). Además, se han identificado especies de malezas tolerantes a altos
niveles de N, denominadas nitrófilas (Biondi
et al. 2012; Moreau et al. 2013, 2014; Vibrans 2014;
Leuschner y
Ellenberg 2017).
Estas plantas mantienen altas tasas fotosintéticas, de acumulación de biomasa y
de crecimiento, aún bajo concentraciones elevadas de Nr, dado que son capaces
de integrarlo rápidamente a sus tejidos, reduciendo su acumulación y
condiciones de toxicidad (Hauck 2010; Dekker 2011).
Identificación de especies
potencialmente tolerantes al N
El uso de malezas como biomonitores parte
de que son organismos comunes en las zonas de interés, cercanos a ambientes
urbanizados (Tabla 1). Asimismo, se busca identificar especies nitrófilas, dado que el depósito
de N en centros urbanos alcanza los 60 kg N ha-1 año-1,
mientras que las especies sensibles tienden a desaparecer
arriba de los 25 kg N ha-1 año-1 y, como ya se
mencionó, sufren daño fisiológico a partir de los 10-20 kg N
ha-1 año-1 (Fig. 3;
Stevens et al. 2004; Pitcairn
et al. 2006; Decina et al. 2020).
Tabla 1. Ejemplos de malezas
que han sido usadas como biomonitores de depósito de N.
Table 1. Examples of weed species that have been used as biomonitors of N
deposition.
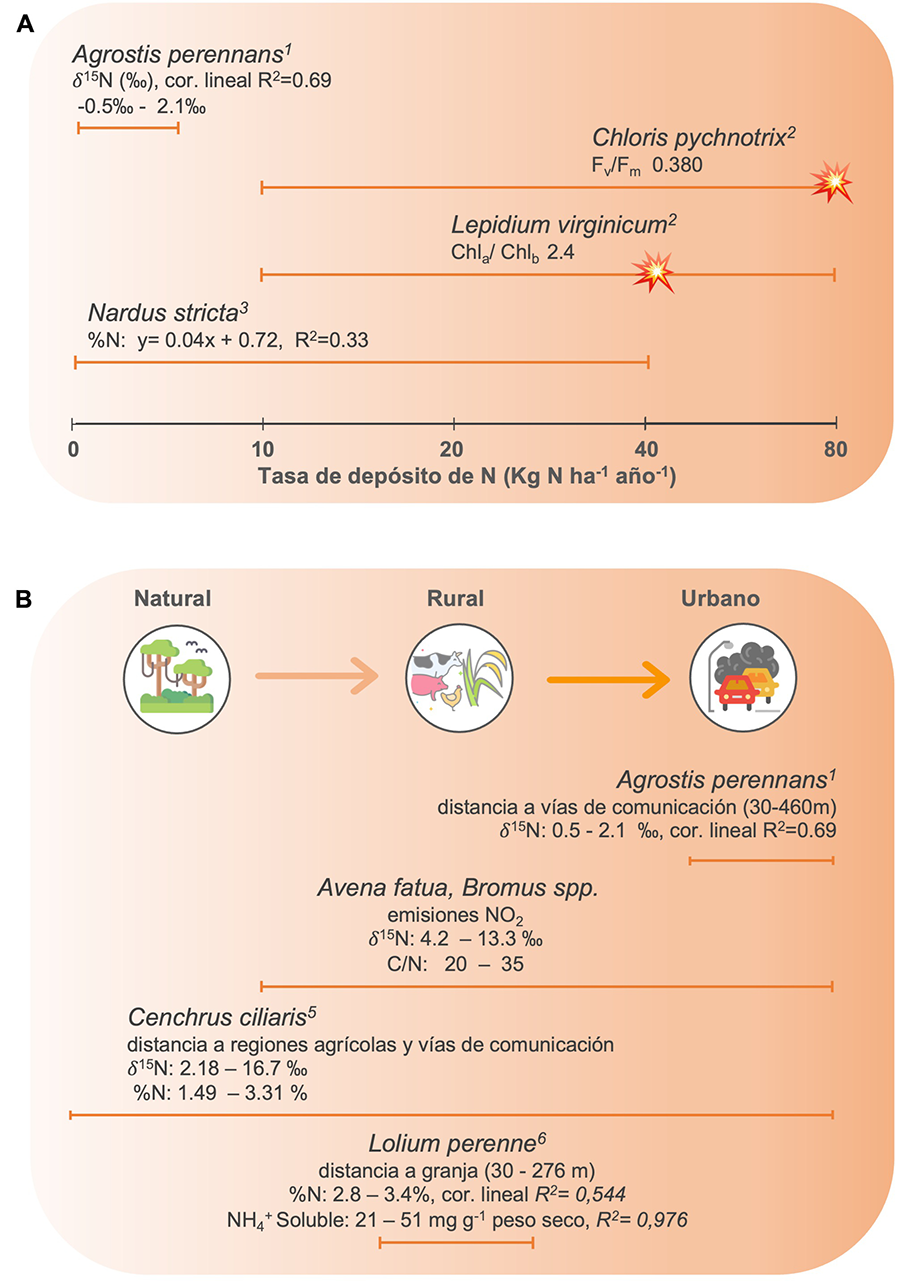
Figura 3. Especies de malezas en las que se han
observado respuestas fisiológicas al depósito de N y con evidencia del inicio
del estrés por exceso de N (💥).
Para cada especie, las líneas naranjas indican la amplitud de la exposición de
las plantas al depósito de N (A) o su ubicación a lo largo de un
gradiente de urbanización (B). Las variables fisiológicas usadas en los
estudios son %N, contenido de N (%); 𝛿15N
huella isotópica del 15N (‰);
Fv/Fm, fluorescencia de la clorofila a; Chla/Chlb,
relación de la clorofila a sobre la b; C/N, relación carbono/ nitrógeno. (Datos
de: 1Redling
et al. 2013, 2Martínez
y de la Barrera 2021, 3Hicks
et al. 2000, 4Wang
y Pataki 2009, 5Díaz-Álvarez
y de la Barrera 2021, 6Sutton et al. 2004).
Figura 3. Weed species for which physiological
responses to N deposition and evidence of the onset of excess N stress (💥)
have been observed. For each species, the organge lines
indicate the range of plant exposure to N deposition (A) or their
position along an urbanization gradient (B). Physiological variables
used in the studies are %N, N content (%); 𝛿15N isotopic signature of 15N (‰); Fv/Fm,
chlorophyll a fluorescence; Chla/Chlb, ratio of
chlorophyll a to b; C/N, carbon to nitrogen ratio. (Data from: : 1Redling
et al. 2013, 2Martínez
y de la Barrera 2021, 3Hicks
et al. 2000, 4Wang
y Pataki 2009, 5Díaz-Álvarez
y de la Barrera 2021, 6Sutton et al. 2004).
Para seleccionar biomonitores potenciales
de depósito de N es conveniente usar especies ya descritas como nitrófilas, por
ejemplo Lolium multiflorum, Ferula communis, Urtica
dioica, Urtica
membranacea, Bromus tectorum, Rumex obtusifolia, Rumex
alpinus y diversos pastos típicos de áreas arables y con disturbio (Schmidtlein 2005; Pitcairn
et al. 2006; Blank et al. 2007; Biondi et al. 2012; Vallano
et al. 2012). Se ha observado que especies como, Chloris
pycnothrix y Lepidium virginicum pueden tolerar tasas altas de
depósito de N, mostrando sensibilidad a tasas por encima de los 40 Kg N ha-1
año-1, como un descenso de la Fv/Fm y de
la relación de la clorofila a/b, respectivamente (Martínez
y de la Barrera 2021).
Algunas como Melinis repens y Taraxacum officinale incluso
incrementan su sobrevivencia bajo 80 Kg N ha-1 año-1 (Martínez
y de la Barrera 2021). Por
su parte, Bidens pilosa, Chloris gayana, Pennisetum setaceum, mantienen
un buen desempeño desde los 10 hasta los 80 Kg N ha-1 año-1,
además de mostrar cambios en distintas variables fisiologicas en repuesta a la
disponibilidad de Nr, por lo que podrían ser potenciales biomonitores (Martínez
y de la Barrera 2021).
Los valores de Ellenberg también pueden ser
una guía adecuada para identificar especies nitrófilas, específicamente
aquellos referentes a disponibilidad de N (Landolt 2001; Vibrans 2014). Si bien dichos valores son de la
vegetación de Europa central, algunas de las malezas incluidas en esos
estudios poseen amplia distribución y corresponden a especies distribuidas en
sitios de alta disponibilidad de N, como Heracleum sphondylium, Lolium perenne, Rumex acetosa, Taraxacum
officinale, Urtica dioica (Hill y Carey 1997; Landolt
2001).
Pastos
La familia Poacea tiene especies que
persisten bajo tasas elevadas de depósito de N y es una de las familias de
malezas más diversas (Bobbink
et al. 2010; Celesti-Grapow
et al. 2013; Martínez-De La Cruz
et al. 2015; Izgördü y Akan 2021; Martínez
et al. 2021b). Hay
estudios en pastos que indican que pueden tolerar condiciones de depósito de N
alto, donde la acidez y la disponibilidad de metales pesados pueden incrementar
y afectar la disponibilidad y absorción de otros nutrientes (Marschner 2012; Tian et al.
2016). En estos organismos se
ha observado que pueden mantener en una relación baja de Mn/Fe en escenarios
donde el exceso de N incrementa la disponibilidad del Mn (Tian et al.
2016). En monocotiledóneas, como los pastos, los mecanismos de adquisición de Fe pueden ser una
clave en la tolerancia (Tian et al.
2016). Esto es debido a que
el Mn entra por el transportador del Fe en dicotiledóneas, un transportador
escaso en monocotiledóneas, lo que permite una relación baja de Mn/Fe (Marschner 2012; Tian et al.
2016).
Los pastos también poseen mecanismos
fisiológicos que les permiten ser eficientes en el uso del agua, la cual puede
ser restrictiva en áreas urbanizadas y zonas secas (Gibson 2009; Czaja et al.
2020). Esto contribuye a la
proliferación de pastos exóticos que suele observarse como resultado de la
urbanización (Capstick
et al. 2019; Martínez et al. 2021b). Por ejemplo, Cenchrus ciliaris, un pasto forrajero que se
comporta como invasor en México, ha sido útil para identificar el aporte de N
derivado de actividades antrópicas (Díaz-Álvarez y de la Barrera 2021).
Dicha especie también puede tolerar altas tasas de depósito de N, dado que logra
mantener la producción de biomasa bajo 50 Kg N ha-1 año-1
(Lyons et al.
2013).
Una fuente no exclusiva de N
Una aparente limitación del uso de plantas
ancladas al suelo es que asimilan distintas fuentes de N. Es decir que su
nutrición no es exclusiva del N que se deposita de la atmósfera, como en
biomonitores epífitos. Sin embargo, el contenido de N total en el tejido
vegetal puede ser indicador de la cantidad de Nr disponible en el ambiente, aún
en plantas ancladas al suelo (Díaz-Álvarez
et al. 2018). De
hecho, el N adquirido por las
partes aéreas de las plantas ancladas al suelo puede alcanzar entre el 25 y 60%
del N total de la planta, facilitando así la producción de hasta el 85% de su
biomasa aérea (Ammann et al. 1999; Sutton et al. 2004; Padgett
et al. 2009). Por ejemplo, en especies herbáceas y
arbustos como Lolium multiflorum, Deschampsia flexuosa, Calluna
vulgaris y Erica cinerea, se han documentado relaciones lineales en
el contenido de N total, con aumentos de 0.04–0.15% (peso seco) por cada kilogramo
que incrementa la tasa de depósito, en el rango de 5 a 40 Kg N ha-1
año-1 (Hicks et al.
2000; Sutton et al. 2004).
Aun teniendo acceso a distintas fuentes de N
para su nutrición, la señal isotópica de los tejidos vegetales permite
distinguir sus contribuciones específicas. Por ejemplo, los valores de δ15N medidos en los pastos Avena
fatua, Bromus diandrus, Bromus hordeaceus, Bromus madritensis y Cenchrus
ciliaris, brindan información sobre la naturaleza de la fuente de Nr y la
distancia a la misma (Fig. 3; Wang y Pataki
2009; Díaz-Álvarez y de la Barrera 2021). También, se ha identificado el cambio de las fuentes predominantes
de Nr a través del tiempo estudiando plantas de herbario colectadas en
distintas (Stewart
et al. 2002).
Comentarios finales
El incremento de la producción de formas reactivas de N ha
sobrepasado el límite planetario que permite el adecuado funcionamiento de los
ecosistemas. Es un factor importante del cambio global, poniendo en riesgo la
salud humana y de los ecosistemas. En áreas urbanas, donde la producción de
formas reactivas de N es alta, es necesario buscar herramientas para
cuantificar su depósito. Las plantas son una alternativa para su biomonitoreo,
dado que las formas reactivas de N suspendidas en la atmósfera se depositan
como NH4+ y NO3- y estas pueden
asimilarlo.
En el biomonitoreo del depósito de N, distintas variables
fisiológicas permiten caracterizar la disponibilidad de N en el ambiente. Tal
es el caso del contenido de N total, la cantidad de proteínas libres, la
concentración de clorofila, la biomasa, así como la relación del N con otros
elementos, como Ca, K, P. Además, la actividad de las enzimas del metabolismo
del N puede ser otro indicador, dado que el Nr asimilado induce su síntesis y actividad.
Por su parte, la herramienta de isótopos estables puede ayudar a identificar
las fuentes de Nr que asimilan los organismos. También, la actividad de enzimas
del metabolismo del N muestra de manera indirecta el incremento de la
disponibilidad de N en el ambiente. Dada la toxicidad del N a nivel celular, la
evaluación de variables fisiológicas indicadoras de estrés, como la producción de
los antioxidantes, el daño a las membranas celulares, la acumulación de pigmentos
accesorios y el descenso de tasas fotosintéticas, puede ser útil en el
biomonitoreo, sobre todo en las malezas más tolerantes.
Las malezas muestran promesa para el biomonitoreo del
depósito de N en áreas urbanas. Son abundantes, toleran el disturbio y se ha
documentado su tolerancia a altas tasas de depósito de N, por encima de los
umbrales en los que comienza el daño fisiológico en otras especies vegetales.
Su evaluación ecofisiológica permite determinar cambios en la disponibilidad de
Nr en el ambiente, así como discernir en las distintas fuentes de emisión.
Agradecimientos
Este trabajo fue financiado por la Dirección General de
Asuntos del Personal Académico, UNAM (Proyecto PAPIIT IN211519). Este trabajo
forma parte de los requisitos para la obtención del grado de Doctor en Ciencias
de DNM en el Posgrado en Ciencias Biológicas (Ecología), UNAM, quien además
contó con una beca del Consejo Nacional de Ciencia y Tecnología, México (CVU
884692).
Contribución
de los autores
D. Nayeli Martínez: Conceptualización, Redacción - borrador
original, Redacción - revisión y edición. Heike Vibrans: Conceptualización,
Redacción - revisión y edición. Francisco J. Espinosa-García: Redacción -
revisión y edición. Morelia Camacho-Cervantes: Redacción - revisión y edición.
Erick de la Barrera: Administración del proyecto, Adquisición de fondos,
Conceptualización, Redacción - revisión y edición.
Referencias
Aber, J.D.,
Nadelhoffer, K.J., Steudler, P., Melillo, J.M. 1989. Nitrogen saturation in
northern forest ecosystems. BioScience 39: 378-386.
Adlimoghaddam, A., Sabbir, M.G., Albensi, B.C. 2016. Ammonia as a potential
neurotoxic factor in alzheimer’s disease. Frontiers in Molecular
Neuroscience 9: 57.
AL-Alam, J., Chbani, A., Faljoun, Z., Millet, M. 2019. The use of
vegetation, bees, and snails as important tools for the biomonitoring of
atmospheric pollution—a review. Environmental Science and Pollution Research
26: 9391-9408.
Ammann, M., Siegwolf, R., Pichlmayer, F., Suter, M., Saurer, M., Brunold,
C. 1999. Estimating the uptake of traffic-derived NO2 from 15N
abundance in Norway spruce needles. Oecologia 118: 124-131.
Apel, K., Hirt,
H. 2004. Reactive oxygen species: Metabolism,
oxidative stress, and signal transduction. Annual Review of Plant Biology
55: 373-399.
Arróniz-Crespo, M., Leake, J.R., Horton, P., Phoenix, G.K. 2008. Bryophyte
physiological responses to, and recovery from, long-term nitrogen deposition
and phosphorus fertilisation in acidic grassland. New Phytologist 180:
864-874.
Ashraf, M.,
Harris, P.J.C. 2013. Photosynthesis under stressful
environments: An overview. Photosynthetica 51: 163-190.
Azcón-Bieto,
J., Talón, M. 2008. Fundamentos de Fisiologia
Vegetal. 2°. McGraw-Hill Interamericana, Madrid, España.
Bassi, D., Menossi, M., Mattiello, L. 2018. Nitrogen
supply influences photosynthesis establishment along the sugarcane leaf. Scientific
Reports 8: 2327.
Biondi, E., Casavecchia, S., Pesaresi, S. 2012. Nitrophilous and ruderal
species as indicators of climate change. Case study from the Italian Adriatic
coast. Plant Biosystems 146: 134-142.
Blank, R.R., Chambers, J., Roundy, B., Whittaker, A. 2007. Nutrient
availability in rangeland soils : Influence of prescribed burning,herbaceous
vegetation removal, overseeding with Bromus tectorum, season, and
elevation. Rangeland Ecology & Management 60: 644-655.
Bobbink, R., Hicks, K., Galloway, J., Spranger, T., Alkemade, R., Ashmore,
M., Bustamante, M., et al. 2010. Global assessment of nitrogen deposition
effects on terrestrial plant diversity: a synthesis. Ecological Applications
20: 30-59.
Britto,
D.T., Kronzucker, H.J. 2002. NH4+
toxicity in higher plants: A critical review. Journal of Plant Physiology
159: 567-584.
Capstick, L.A., Draycott, R.A.H., Wheelwright, C.M., Ling, D.E., Sage, R.B.,
Hoodless, A.N. 2019. The effect of game management on the conservation value of
woodland rides. Forest Ecology and Management 454: 117242.
Celesti-Grapow, L., Capotorti, G., Del Vico, E., Lattanzi, E., Tilia, A., Blasi,
C. 2013. The vascular flora of Rome. Plant Biosystems 147: 1059-1087.
Cobley,
L.A.E., Pataki, D.E. 2019. Vehicle emissions and
fertilizer impact the leaf chemistry of urban trees in Salt Lake Valley, UT. Environmental
Pollution 254: 112984.
Crutzen,
P.J., Günter, H.B. 2016. Paul J. Crutzen: A
Pioneer on Climate Change in Chemistry and Atmospheric the Anthropocene.
Springer, Mosbach, Germany.
Czaja, M., Kołton, A., Muras, P. 2020. The Complex Issue of Urban
Trees—Stress Factor Accumulation and Ecological Service Possibilities. Forests
11: 932.
Dawson, T.E., Mambelli, S., Plamboeck, A.H., Templer, P.H., Tu, K.P. 2002.
Stable Isotopes in Plant Ecology. Annual Review of Ecology and Systematics
33: 507-559.
de Vries, W. 2021. Impacts of nitrogen emissions on ecosystems and human
health: A mini review. Current Opinion in Environmental Science and Health
21: 100249.
Decina, S.M., Hutyra, L.R., Templer, P.H. 2020. Hotspots of nitrogen
deposition in the world’s urban areas: a global data synthesis. Frontiers in
Ecology and the Environment 18: 92-100.
DeHayes, D.H., Schaberg, P.G., Hawley, G.J., Strimbeck, G.R. 1999. Acid
rain impacts on calcium nutrition and forest health. BioScience 49:
789-800.
Dekker, J. 2011. Evolutionary Ecology of Weeds. Weed Biology
Laboratory, Agronomy Department, Iowa, USA.
Demidchik, V. 2015. Mechanisms of oxidative stress in plants: From classical
chemistry to cell biology. Environmental and
Experimental Botany 109: 212-228.
Díaz-Álvarez,
E.A., de la Barrera, E. 2021. Influence of land use on the C and N status of a C4
invasive grass in a semi-arid region: Implications for biomonitoring. Plants 10: 1-16.
Díaz-Álvarez, E.A., Lindig-Cisneros, R., de la Barrera, E. 2018. Biomonitors of atmospheric nitrogen deposition: Potential uses and
limitations. Conservation Physiology 6: 1110-1093.
Díaz-Álvarez, E.A.A., De la Barrera, E., Arciga-Pedraza, A., Arróniz-Crespo,
M. 2019. Bryophyte enzymatic responses to atmospheric
nitrogen deposition : A field validation for potential biomonitors. The
Bryologist 122: 396-403.
Díaz-Álvarez, E.A., de la Barrera, E., Barrios-Hernández, E.Y., Arróniz-Crespo,
M. 2020. Morphophysiological screening of potential
organisms for biomonitoring nitrogen deposition. Ecological Indicators
108: 105729.
Douglas, I., Goode, D., Houck, M., Wang, R. 2011. The Routledge Handbook
of Urban Ecology. Routledge, Oxon, UK.
Eldor, A.P. 2007. Soil Microbiology, Ecology, and Biochemistry. Academic
Press is an imprint of Elsevier, Oxford, UK.
Elliott, E.M., Kendall, C., Wankel, S.D., Burns, D.A., Boyer, E.W., Harlin,
K., Bain, D.J., et al. 2007. Nitrogen isotopes as indicators of NOx
source contributions to atmospheric nitrate deposition across the Midwestern
and Northeastern United States. Environmental
Science & Technology 41: 7661-7667.
Espinosa-García, F.J., Sánchez-Blanco, J., Reyes, N.P., Guevara-Féfer, F. 2019.
Malezas. En: La Biodiversidad en Michoacán. Estudio de Estado 2, pp.
267-273. CONABIO, Ciudad de México, México.
Felix, J.D., Avery, G.B., Mead, R.N., Kieber, R.J., Willey, J.D. 2016. Nitrogen content and isotopic composition of spanish moss (Tillandsia
usneoides L.): Reactive nitrogen variations and source implications across
an urban coastal air shed. Environmental Processes 3: 711-722.
Foley, J. a, Defries, R., Asner, G.P., Barford, C., Bonan, G., Carpenter,
S.R., Chapin, F.S., et al. 2005. Global consequences of land use. Science
309: 570-4.
Forbes, P.B.C., van der Wat, L., Kroukamp, E.M. 2015. Biomonitors. En:
Forbes, P.B.C. (ed.), Comprehensive Analytical Chemistry, pp. 53-108.
Elsevier, Oxford, UK.
Galloway, J.N., Aber, J.D., Erisman, J.W., Seitzinger, S. ybil P., Howarth,
R.W., Cowling, E.B., et al. 2003. The nitrogen cascade. BioScience 53:
341-356.
Galloway, J., Dentener, F., Capone, D.G., Boyer, E.W., Howarth, R.W.,
Seitzinger, S.P., Asner, G.P. et al. 2004. Nitrogen cycles: Past, present,
and future. Biogeochemistry 70: 153-226.
GBIF 2023. Global Biodiversity Information Facility, Copenhague, Dinamarca. [Accedido 13 de mayo de 2022]. Disponible
en: https://www.gbif.org/
Gibson, D.J. 2009. Grasses and Grassland Ecology. Oxford University Press,
Oxford, UK.
Godavari, H.R., Chin, C.K., Waygood, E.R. 1976. Effect of benzimidazole on
nicotinamide adenine dinucleotide phosphate phosphomonosterase activity in
wheat leaves. Experientia 32: 1140-1142.
González, C.M., Orellana, L.C., Casanovas, S.S., Pignata, M.L. 1998. Environmental conditions and chemical response of a transplanted
lichen to an urban area. Journal of Environmental Management 53: 73-81.
González, Z.C.A., Vallarino, A., Pérez, J.J.C., Low, P.A.M. 2014. Bioindicadores: Guardianes de Nuestro Futuro Ambiental. El Colegio de la Frontera Sur (Ecosur), Instituto Nacional de
Ecología y Cambio Climático (INECC), Cd. de México, México.
Hanan-Alipi,
A.M., Vibrans, H. 2015. Las malezas: un
laboratorio natural para el estudio de la evolución. Revista fuente nueva epoca 6: 41-47.
Hauck, M. 2010. Ammonium and nitrate tolerance in lichens. Environmental
Pollution 158: 1127-1133.
Hicks, W.K., Leith, I.D., Woodin, S.J., Fowler, D. 2000. Can the foliar
nitrogen concentration of upland vegetation be used for predicting atmospheric
nitrogen deposition? Evidence from field surveys. Environmental Pollution
107: 367-376.
Hill, M.O.,
Carey, P.D. 1997. Prediction of yield in the
Rothamsted park grass experiment by Ellenberg indicator values. Journal of
Vegetation Science 8: 579-586.
Hoff, T., Stummann, B.M., Henningsen, K.W. 1992. Structure, function and
regulation of nitrate reductase in higher plants. Physiologia Plantarum
84: 616-624.
Horswill, P., O’Sullivan, O., Phoenix, G.K., Lee, J.A., Leake, J.R. 2008.
Base cation depletion, eutrophication and acidification of species-rich
grasslands in response to long-term simulated nitrogen deposition. Environmental
Pollution 155: 336-349.
IPCC 2013. Climate Change 2013: The Physical Science Basis. Contribution
of Working Group I to the Fifth Assessment Report of the Intergovernmental
Panel on Climate Change. Cambridge, UK and New
York, USA.
Izgördü, Z.,
Akan, H. 2021. Floristic
composition in the ruderal areas of Southeast Anatolia, Turkey. Bangladesh
Journal of Plant Taxonomy 28: 241-256.
Izquieta-Rojano, S.,
López-Aizpún, M., Irigoyen, J.J., Santamaría, J.M., Santamaría, C., Lasheras,
E., Ochoa-Hueso, R., et al. 2018. Eco-physiological response
of Hypnum cupressiforme Hedw. to increased atmospheric ammonia
concentrations in a forest agrosystem. Science of the Total Environment
619-620: 883-895.
Janga,
A.P., Raghuram, N. 2015. Nitrogen and stress. En:
Pandey, G.K. (ed.), Elucidation of Abiotic Stress Signaling in Plants.
Functional Genomics Perspectives, Volume 2, pp. 323-240. Springer, New
York, USA.
Johansson, O., Nordin, A., Olofsson, J., Palmqvist, K. 2010. Responses of
epiphytic lichens to an experimental whole-tree nitrogen-deposition gradient. New
Phytologist 188: 1075-1084.
Johnson, D., Leake, J.R., Lee, J.A. 1999. The effects of quantity and
duration of simulated pollutant nitrogen deposition on root-surface phosphatase
activities in calcareous and acid grasslands: A bioassay approach. New
Phytologist 141: 433-442.
Kaiser, J.J.,
Lewis, O.A.M. 1984. Nitrate reductase and glutamine
synthetase activity in leaves and roots of nitrate-fed Helianthus annuus
L. Plant and Soil 77: 127-130.
Kapoor, C.S., Bamniya, B.R., Kapoor, K. 2013. Efficient control of air
pollution through plants, a cost-effective alternative: Studies on Dalbergia
sissoo Roxb. Environmental Monitoring and Assessment 185: 7565-7580.
Kapoor, D., Singh, S., Kumar, V., Romero, R., Prasad, R., Singh, J. 2019.
Antioxidant enzymes regulation in plants in reference to reactive oxygen
species (ROS) and reactive nitrogen species (RNS). Plant Gene 19:
100182.
Khalid, N., Noman, A., Masood, A., Tufail, A., Hadayat, N., Alnusairi,
G.S.H., Alamri, S., et al. 2020. Air pollution on highways and motorways
perturbs carbon and nitrogen levels in roadside ecosystems. Chemistry and
Ecology 36: 868-880.
Kogelmann,
W.J., Sharpe, W.E. 2006. Soil acidity and manganese
in declining and nondeclining sugar maple stands in Pennsylvania. Journal of
Environmental Quality 35: 433-441.
Kong, W., Liu, F., Zhang, C., Zhang, J., Feng, H. 2016. Non-destructive
determination of malondialdehyde (MDA) distribution in oilseed rape leaves by
laboratory scale NIR hyperspectral imaging. Scientific Reports 6: 1-8.
Kronzucker, H.J., Britto, D.T., Davenport, R.J., Tester, M. 2001. Ammonium
toxicity and the real cost of transport. Trends in Plant Science 6:
335-337.
Landolt, E. 2001. Flora der Stadt Zürich (1984–1998). Springer Basel
AG, Basel, Schweiz.
Leuschner,
C., Ellenberg, H. 2017. Ecology of Central
European Forests. Vegetation Ecology of Central Europe, Volume I. Springer,
Cham, Switzerland.
Liu, X.J., Xu, W., Du, E.Z., Tang, A.H., Zhang, Y., Zhang, Y.Y., Wen,
Z., et al. 2020. Environmental impacts of nitrogen emissions in China and
the role of policies in emission reduction: Reactive nitrogen issues in China. Philosophical
Transactions of the Royal Society A: Mathematical, Physical and Engineering
Sciences 378: 20190324.
Lyons, K.G., Maldonado-Leal, B.G., Owen, G. 2013. Community and ecosystem
effects of buffelgrass (Pennisetum ciliare) and nitrogen deposition in
the Sonoran desert. Invasive Plant Science and Management 6: 65-78.
Markert, B.A., Breure, A.M., Zechmeister, H.G. 2003. Bioindicators &
Biomonitors: Principles, Concepts and Applications. Elsevier Science Ltd.,
Oxford, UK.
Marschner, P.
2012. Mineral nutrition of higher plants. 3.a ed. Elsevier Ltd, San Diego, CA. USA.
Martínez-De
La Cruz, I., Vibrans, H., Lozada-Pérez, L.,
Romero-Manzanares, A., Aguilera-Gómez, L.I., Rivas-Manzano, I.V. 2015. Plantas
ruderales del área urbana de Malinalco, Estado de México, México. Botanical Sciences 93: 907-919.
Martínez,
D.N., de la Barrera, E. 2021. Physiological
screening of ruderal weed biomonitors of atmospheric nitrogen deposition. Botanical Sciences 1: 573-587.
Martínez, D.N., Díaz-Álvarez, E.A., de la Barrera, E. 2021a. Selecting biomonitors of atmospheric nitrogen deposition: Guidelines
for practitioners and decision makers. Nitrogen 2: 308-320.
Martínez, D.N., López-Toledo, L., Espinosa-García, F., Camacho-Cervantes,
M., de la Barrera, E. 2021b. Ephemeral visitors or
permanent residents? — Decadal change in the ruderal vegetation from a
periurban university campus. Urban Forestry & Urban Greening 65:
127372.
McKinney, M.L. 2006. Urbanization as a major cause of biotic
homogenization. Biological Conservation 127: 247-260.
Meinzer, F.C.,
Zhu, J. 1998. Nitrogen stress reduces the
efficiency of the C4 CO2 concentrating system, and therefore quantum
yield, in Saccharum (sugarcane) species. Journal of Experimental Botany
49: 1227-1234.
Moreau, D.,
Milard, G., Munier-Jolain, N. 2013. A plant nitrophily index based on plant
leaf area response to soil nitrogen availability. Agronomy for Sustainable Development 33: 809-815.
Moreau, D., Busset, H., Matejicek, A., Munier-Jolain, N. 2014. The
ecophysiological determinants of nitrophily in annual weed species. Weed
Research 54: 335-346.
Nagajyoti, P.C., Lee, K.D., Sreekanth, T.V.M. 2010. Heavy metals, occurrence
and toxicity for plants: A review. Environmental Chemistry Letters 8:
199-216.
NZPCN 2023. New Zealand Plant Conservation Network, Mangōnui, New Zealand. [Accedido 22 de septiembre de 2023]. Disponible en: https://www.nzpcn.org.nz/
Ochoa-Hueso, R., Paradela, C., Pérez-Corona, M.E., Manrique, E. 2014. Pigment ratios of the mediterranean bryophyte Pleurochaete
squarrosa respond to simulated nitrogen deposition. En Sutton, M. A.,
Mason, K. E., Sheppard, L. J., Sverdrup, H., Haeuber, R., Hicks, W. K. (eds.), Nitrogen
Deposition, Critical Loads and Biodiversity, pp. 207-216. Springer
Dordrecht, The Netherlands.
Padgett, P.E., Cook, H., Bytnerowicz, A., Heath, R.L. 2009. Foliar loading
and metabolic assimilation of dry deposited nitric acid air pollutants by
trees. Journal of Environmental Monitoring 11: 75-84.
Peñuelas,
J., Filella, I. 2001. Herbaria century record of
increasing eutrophication in Spanish terrestrial ecosystems. Global Change
Biology 7: 427-433.
Piazzetta, K.D., Ramsdorf, W.A., Maranho, L.T. 2019. Use of airplant Tillandsia
recurvata L., Bromeliaceae, as biomonitor of urban air pollution. Aerobiologia
35: 125-137.
Pineda,
R.A.L., Venegas, L.E. 2008. Dry and wet deposition
of nitrogen emitted in Buenos Aires City to waters of de la Plata River. Water,
Air, and Soil Pollution 193: 175-188.
Pitcairn, C.E.R., Leith, I.D., Sheppard, L.J., Sutton, M.A., CEH. 2006.
Development of a nitrophobe/nitrophile classification for woodlands, grasslands
and upland vegetation in Scotland. NERC/Centre for Ecology and Hydrology, 24pp.
(CEH: Project Report Number: C03066). Disponible en: https://nora.nerc.ac.uk/id/eprint/3379
Png, G.K., Turner, B.L., Albornoz, F.E., Hayes, P.E., Lambers, H.,
Laliberté, E. 2017. Greater root phosphatase activity in nitrogen-fixing
rhizobial but not actinorhizal plants with declining phosphorus availability. Journal
of Ecology 105: 1246-1255.
Poschenrieder, C., Gunsé, B., Corrales, I., Barceló, J. 2008. A glance into
aluminum toxicity and resistance in plants. Science of the Total Environment
400: 356-368.
Pyšek, P., Chocholoušková, Z., Pyšek, A., Jarošík, V., Chytrý, M., Tichý,
L. 2004. Trends in species diversity and composition of urban vegetation over
three decades. Journal of Vegetation Science 15: 781-788.
Redling, K., Elliott, E., Bain, D., Sherwell, J. 2013. Highway
contributions to reactive nitrogen deposition: Tracing the fate of vehicular NOx
using stable isotopes and plant biomonitors. Biogeochemistry 116:
261-274.
Roem, W.J.,
Berendse, F. 2000. Soil acidity and nutrient supply
ratio as possible factors determining changes in plant species diversity in
grassland and heathland communities. Biological Conservation 92:
151-161.
Sala, O.E., Chapin III, F.S., Armesto, J.J., Berlow, E., Dirzo, R.,
Huber-sanwald, E., Huenneke, L.F., et al. 2000. Global biodiversity
scenarios for the year 2100. Science 287: 1770-1774.
Salemaa, M., Mäkipää, R., Oksanen, J. 2008. Differences in the growth
response of three bryophyte species to nitrogen. Environmental
Pollution 152: 82-91.
Santiago, L.S., Silvera, K., Andrade, J.L., Dawson, T.E. 2005. El uso de
isótopos estables en biologia tropical. Interciencia 30: 536-542.
Schmidtlein,
S. 2005. Imaging spectroscopy as a tool for mapping
Ellenberg indicator values. Journal of Applied Ecology 42: 966-974.
Schneider, J.R., Caverzan, A., Chavarria, G. 2019. Water deficit stress, ROS
involvement, and plant performance. Archives of Agronomy and Soil Science
65: 1160-1181.
Sommer, S.G., Østergård, H.S., Løfstrøm, P., Andersen, H. V, Jensen, L.S.
2009. Validation of model calculation of ammonia deposition in the
neighbourhood of a poultry farm using measured NH3 concentrations
and N deposition. Atmospheric Environment 43: 915-920.
Srivastava,
H.S. 1980. Regulation of nitrate reductase activity
in higher plants. Phytochemistry 19: 725-733.
Steffen, W., Richardson, K., Rockström, J., Cornell, S.E., Fetzer, I.,
Bennett, E.M., Biggs, R., et al. 2015. Planetary boundaries: Guiding human
development on a changing planet. Science 347: 1259855.
Stevens, C.J., Dupr, C., Dorland, E., Gaudnik, C., Gowing, D.J.G., Bleeker,
A., Diekmann, M., et al. 2011. The impact of nitrogen deposition on acid
grasslands in the Atlantic region of Europe. Environmental Pollution
159: 2243-2250.
Stevens, J.C., Dise, N.B., Mountford, J.O., Gowing, D.J. 2004. Impact of
nitrogen deposition on the species richness of grasslands. Science 303:
1876-1879.
Stewart, G.R., Aidar, M.P.M.M., Joly, C.A., Schmidt, S. 2002. Impact of
point source pollution on nitrogen isotope signatures (δ15N)
of vegetation in SE Brazil. Oecologia 131: 468-472.
Sutton, M. a, Pitcairn, C.E.R., Whitfield, C.P. 2004. Bioindicator and
biomonitoring methods for assessing the effects of atmospheric nitrogen on
statutory nature conservation sites. JNCC Report
No: 356. 1-232. Disponible en:
https://data.jncc.gov.uk/data/ff165313-018d-46b9-9c4d-3f3dc25d9a27/JNCC-Report-356-FINAL-WEB.pdf.
Šilc, U. 2015. Biotic homogenization and differentiation in weed vegetation over
the last 70 years. Open Life Sciences 10: 537-545.
Tegeder,
M., Masclaux-Daubresse, C. 2018. Source and sink
mechanisms of nitrogen transport and use. New Phytologist 217: 35-53.
Tian, D.S., Niu,
S.L. 2015. A global analysis of soil acidification
caused by nitrogen addition. Environmental Research Letters 10: 024019.
Tian, Q., Liu, N., Bai, W., Li, L., Chen, J., Reich, P.B., Yu, Q.,
et al. 2016. A novel soil manganese mechanism drives plant species loss
with increased nitrogen deposition in a temperate steppe. Ecology 97:
65-74.
Townsend, A.R., Howarth, R.W., Bazzaz, F.A., Booth, M.S., Cleveland, C.C.,
Collinge, S.K., Dobson, A.P., et al. 2003. Human health effects of a
changing global nitrogen cycle. Frontiers in Ecology and the Environment
1: 240.
Tropicos 2023. Agrostis perennans (Walter) Tuck. [Accedido 13 de mayo de
2022]. Disponible en: https://tropicos.org/name/25502790
Vallano, D.M., Selmants, P.C., Zavaleta, E.S. 2012. Simulated nitrogen deposition enhances the performance of an exotic
grass relative to native serpentine grassland competitors. Plant Ecology
213: 1015-1026.
van den Berg, L.J.L., Dorland, E., Vergeer, P., Hart, M.A.C., Bobbink, R.,
Roelofs, J.G.M. 2005. Decline of acid-sensitive plant species in heathland can
be attributed to ammonium toxicity in combination with low pH. New
Phytologist 166: 551-564.
Varela, Z., Aranda, S.C., Estébanez Pérez, B., Medina, N.G., Boquete,
M.T. 2017. Empleo de criptógamas como herramienta ecológica de
biomonitorización del depósito de nitrógeno en la península ibérica. Ecosistemas
26: 45-54.
Vibrans, H. 2014. Las malezas como indicadoras ambientales. En: González
Zuarth, C.A., Vallarino, A., JPérez Jiménez, J.C., Low Pfeng, A.M. (eds.), Bioindicadores:
Guardianes de Nuestro Futuro Ambiental, pp. 625-652. El Colegio de la
Frontera Sur (Ecosur), Instituto Nacional de Ecología y Cambio Climático
(INECC), Cd. de México, México.
Villaseñor, J.L., Espinosa-Garcia, F.J. 2004. The alien flower plants of Mexico. Diversity
and Distributions 10: 113-123.
Vitousek, P.M., Aber, J.D., Howarth, R.W., Likens, G.E., Matson, P.A.,
Schindler, D.W., Schlesinger, W.H., et al. 1997. Human alteration of the global
nitrogen cycle: sources and consequences. Ecological Applications 7:
737-750.
Wang, W.,
Pataki, D.E. 2009. Spatial patterns of plant
isotope tracers in the Los Angeles urban region. Landscape Ecology 25:
35-52.
Wang, Y., Teng, Z.Y., Zhang, X.L., Che, Y.H., Sun, G.Y. 2019. Research
progress on the effects of atmospheric nitrogen dioxide on plant growth and
metabolism. Chinese Journal of Applied Ecology 30: 316-324.
WHO 2003. Health aspects of air pollution with particulate matter, ozone
and nitrogen dioxide. World Health Organization, Bonn, Alemania.
WHO 2011. Nitrate and nitrite in drinking-water. World Health
Organization, Geneva, Switzerland.
Xiao, H.Y., Xie, Z.Y., Tang, C.G., Wang, Y.L., Liu, C.Q. 2011. Epilithic
moss as a bio-monitor of atmospheric N deposition in South China. Journal of
Geophysical Research Atmospheres 116: D24301.
Yang, L., Qian, F., Song, D.X., Zheng, K.J. 2016. Research on urban
heat-island effect. Procedia Engineering 169: 11-18.
Zandalinas,
S.I., Mittler, R. 2022. Plant responses to
multifactorial stress combination. New Phytologist 234: 1161-11 67.
![]() , Heike Vibrans3
, Heike Vibrans3 ![]() , Francisco J. Espinosa-García2
, Francisco J. Espinosa-García2 ![]() , Morelia Camacho-Cervantes4
, Morelia Camacho-Cervantes4 ![]() , Erick de la Barrera2,*
, Erick de la Barrera2,* ![]()


