ecosistemas
ISSN 1697-2473
Open access / CC BY-NC 4.0
© 2024 Los autores
MONOGRÁFICO: Biodiversidad y funcionamiento de los ríos intermitentes: retos en un contexto de cambio global
Editoras: Pilar Hurtado y Rebeca Arias-Real
Ecosistemas 33(1): 2598 [enero-abril 2024]: https://doi.org/10.7818/ECOS.2598
ARTÍCULO DE INVESTIGACIÓN
Relevancia de los ríos intermitentes y arroyos efímeros
de montaña sobre la diversidad de líquenes anfibios
Gregorio Aragón1,*  , Patricia Pineros1
, Patricia Pineros1  , Marina Vicente2
, Marina Vicente2  , Gil
Fernando Giménez3
, Gil
Fernando Giménez3  , Pilar Hurtado1,4
, Pilar Hurtado1,4 
(1) Área de Biodiversidad y
Conservación, Departamento de Biología y Geología, Física y Química Inorgánica,
Universidad Rey Juan Carlos, 28933 Móstoles, Madrid, España.
(2) Departamento de Anatomía,
Biología Celular y Zoología, Universidad de Extremadura, Avda. de Elvas s/n.,
06006 Badajoz, España.
(3) Parque Nacional de
Cabañeros, Ctra. Torrijos s.n., 13194–Pueblonuevo del Bullaque, España.
(4) Dipartimento di Farmacia,
Università di Genova, viale Cembrano, 4, 16148, Genova, Italy.
Autor de correspondencia*: Gregorio
Aragón [gregorio.aragon@urjc.es]
|
> Recibido el 26 de junio de 2023 - Aceptado el 24 de julio de 2023
|
Como
citar: Aragón, G.,
Pineros, P., Vicente, M., Giménez, G.F., Hurtado, P. 2024 Relevancia de los ríos intermitentes y
arroyos efímeros de montaña sobre la diversidad de líquenes anfibios. Ecosistemas
33(1):
2632. https://doi.org/10.7818/ECOS.2598
|
Relevancia de
los ríos intermitentes y arroyos efímeros de montaña sobre la diversidad de
líquenes anfibios
Resumen: Ríos intermitentes y arroyos efímeros
constituyen corrientes de agua que dejan de fluir y/o se secan completamente
en algún punto del tiempo y espacio, de forma que los organismos han de
adaptarse a la temporalidad de estos hábitats con ciclos de inmersión y
secado variables en el tiempo e intensidad. Uno de los organismos adaptados a
vivir en estos ambientes son los líquenes anfibios o semiacuáticos que
colonizan rocas estables en aguas no eutrofizadas. Partiendo de la existencia
de adaptaciones morfológicas y anatómicas que han desarrollado los líquenes
para vivir en estos ambientes, nos preguntamos sobre la especificidad que
tienen por los ambientes acuáticos, y si podrían desarrollarse también en
ambientes terrestres. Se han seleccionado 50 especies de líquenes con
afinidad por el agua dulce, se ha extraído la información de todas las citas
del nodo GBIF España, y se ha completado la información del hábitat usando
referencias bibliográficas en el caso de que faltaran. Los resultados
muestran una fuerte especificidad por el medio acuático de las 36 especies
que viven regularmente sumergidas o en zonas inundadas después de las
lluvias. Algunas de ellas como Pseudosagedia guentheri, Polyblastia
quartzina o Pyrenocollema saxicola solo han sido citadas en una o
dos ocasiones. Además, gran parte de las citas están relacionadas con
sistemas acuáticos en zonas de montaña (>1300 m de altitud). Los cursos de
agua de zonas de montaña constituyen hábitats idóneos para el desarrollo de
los líquenes anfibios, especialmente los tramos asociados a gargantas y
rápidos, con aguas oligotróficas y gran extensión de roca expuesta.
Palabras clave: altitud; cursos
de agua; GBIF; líquenes acuáticos; Península Ibérica
Relevance of intermittent
rivers and ephemeral mountain streams on the diversity of amphibious lichens
Abstract: Intermittent rivers and
ephemeral streams are watercourses that cease flowing and/or completely dry
out at some point in time and space. This temporal dynamic requires organisms
to adapt to the varying immersion and drying cycles in terms of time and intensity.
Among the organisms adapted to these environments are amphibious or
semiaquatic lichens who colonize stable rocks in non-eutrophicated waters.
Given the morphological and anatomical adaptations that lichens have
developed to survive in such environments, we assess their specificity to
aquatic environments and their potential to thrive in terrestrial habitats.
Here, we selected fifty lichen species with a preference for freshwater
habitats and retrieved information from the records available in the GBIF
Spain database. Supplementary habitat information was obtained from relevant
bibliographic references when needed. The results showed a strong specificity
for aquatic environments among the 36 species that commonly thrive in
submerged or inundated areas after rainfall. We highlight the presence of a
few rare species such as Pseudosagedia guentheri, Polyblastia quartzina
and Pyrenocollema saxicola, which have only been reported once or
twice. Notably, a significant proportion of these records were associated to
aquatic systems in mountainous areas (>1300 m in altitude). Overall,
watercourses in mountainous regions constitute suitable habitats for the
development of amphibious lichens, especially in gorges and rapids,
characterized by oligotrophic waters and extensive exposed rock surfaces.
Keywords: altitude;
aquatic lichens; GBIF; Iberian Peninsula; water flows
|
Introducción
Los ríos intermitentes y arroyos efímeros integran parte de
los sistemas acuáticos continentales que sufren la interrupción periódica del
caudal o incluso el secado completo del cauce (Gallart
et al. 2016; Datry et al. 2017) y, aunque el
momento de la sequía estacional suele ser predecible, la intensidad del flujo
del caudal experimenta una fuerte variabilidad interanual (Cid
et al. 2016; Carcavilla et al. 2017). Estos
cursos de agua temporales son comunes en muchas zonas del mundo, especialmente
en las zonas secas, donde su número y extensión se están viendo incrementados
debido al cambio climático y a las actividades humanas que implican un consumo
de agua (Tooth 2000; Larned et
al. 2010; Gallart et al. 2016). Estos
ecosistemas cada vez más extendidos, constituyen el hábitat de multitud de
especies (Gallart et al. 2016), a pesar de que el
cese del caudal representa una etapa crítica con cambios en la disponibilidad y
calidad del hábitat (Boulton 2003).
Una
característica sobresaliente de los cursos de agua temporales es la
particularidad de la vida acuática que albergan, ya que las comunidades
biológicas requieren poseer adaptaciones para hacer frente a la temporalidad en
el flujo de agua (Larned et al. 2010; Cid et al.
2016). Uno de los grupos de
organismos adaptados a vivir en hábitats acuáticos temporales son los líquenes
(Nascimbene y Nimis 2006; Nascimbene et al. 2009), que van a constituir
importantes elementos de vegetación sobre las superficies rocosas de estos
cursos agua (Thüs 2002; Nascimbene y Nimis 2006; Nascimbene et al. 2009). En estos ambientes, los
líquenes se ven afectados por varios factores ecológicos relacionados con la
duración en el tiempo de inmersión, las características del sustrato (litología
y estabilidad), la disponibilidad de luz, la calidad del agua, la composición
química, y la velocidad y el flujo del agua (Keller
y Scheidegger 1994; Gilbert 1996; Gilbert y Giavarini 1997, 2000; Thüs 2002; Aptroot y Seaward 2003; Krzewicka y Galas 2006; Nascimbene et al. 2007). La mayoría de los
líquenes anfibios están relacionados con condiciones de buena iluminación, de
forma que en zonas más umbrosas la diversidad de especies desciende
considerablemente (Nascimbene et al. 2013).
Además, el tipo de roca es especialmente importante, ya que necesitan un
sustrato rocoso estable y resistente a la erosión, de forma que hay muy pocas
especies especializadas en sustratos calcáreos, ya que sufren una mayor erosión
mecánica y química (Hawksworth 2000; Nascimbene y Nimis 2006). Por otro lado, la
calidad del agua va a ser determinante en la supervivencia de las especies, ya
que la sedimentación limita el crecimiento de los líquenes, interfiriendo en la
penetración de la luz y ejerciendo un estrés mecánico cuando se deposita sobre
los talos de los líquenes (Thüs 2002).
La mayoría de los líquenes de agua dulce viven sumergidos
solo durante una parte del año (líquenes anfibios o semiacuáticos) (Aptroot y Seaward 2003; Thüs
et al. 2014), por lo que se tienen que adaptar a los ciclos de humectación
y secado que experimentan durante las fluctuaciones diurnas y estacionales en
la disponibilidad de agua (Coste et al. 2016). Así,
en función del tiempo de inmersión al que van a estar sometidos los talos en
los cursos de agua, se han considerado varias zonas o bandas (Pereira et al. 1987; Gilbert
1996; Valcárcel y Carballal 2002; Coste 2010; Hachulka 2011; Thüs et al. 2014; Krzewicka et al. 2017): (A) zona regularmente
sumergida, donde los líquenes viven sumergidos una gran parte del año (algunos
autores indican que más de 6-9 meses), (B) zona sumergida en las crecidas,
donde los líquenes están sumergidos regularmente después de las lluvias, y cuando
no están sumergidos, están humedecidos por aerosol del agua (zona de
salpicadura); (C) zona terrestre, sujeta a inundaciones episódicas después de
fuertes lluvias y agua de escorrentía. Los líquenes que colonizan estas zonas
se corresponden con un número escaso de grupos taxonómicos que, además, suele
ser bastante homogéneos a lo largo del mundo (Aptroot
y Seaward 2003). En Europa hay reconocidas cerca de 150 especies con mayor
o menor afinidad por el agua dulce, y alrededor de 250 especies a lo largo del
mundo (Nascimbene et al. 2013). La cuestión que
nos preguntamos es si los líquenes asociados a ambientes de agua dulce,
principalmente ríos y arroyos, son capaces de desarrollarse fuera de estos
hábitats, en zonas terrestres, sin contacto con el agua. En este caso, los ríos
intermitentes y arroyos efímeros serían cruciales para la supervivencia de
estas especies y, en particular, los tramos asociados con gargantas, rápidos y
cascadas, con una gran extensión de roca expuesta y ausencia de contaminación,
se constituirían como las zonas con mayor diversidad y abundancia de especies
de líquenes anfibios.
En este contexto, cabría esperar que un hábitat tan
particular como los ríos intermitentes y arroyos efímeros, sujetos a periodos
de inundación y sequía, alberguen un conjunto de líquenes adaptados a esta
temporalidad. De esta forma, las especies que estén mejor adaptadas a crecer en
zonas con periodos de inundación más largos y constantes serán más proclives a
desaparecer con un aumento de la estacionalidad y en el medio terrestre,
mientras que las especies adaptadas a vivir en zonas donde las inundaciones son
episódicas, será más probable que colonicen otros medios terrestres húmedos,
aunque no necesariamente ligados a cauces de agua dulce. Por tanto, nos
preguntamos sobre la especificidad de las especies de líquenes anfibios por
estos hábitats tan particulares y tan poco estudiados en la Península Ibérica.
Materiales y métodos
Para la consecución del objetivo planteado, se obtuvo un
listado preliminar de las especies de líquenes asociadas a hábitats de agua
dulce en la Península Ibérica, donde además se recogían sus preferencias en
cuanto al tiempo de inundación en una distribución zonal (Pereira et al. 1987; Gilbert
1996; Valcárcel y Carballal 2002; Coste 2010; Hachulka 2011; Thüs et al. 2014; Krzewicka
et al. 2017) (ver introducción). Para cada una de las especies recogidas en
el listado preliminar, se obtuvo su distribución peninsular utilizando el nodo
GBIF España (https://www.gbif.es/),
excluyendo todas aquellas que no estuvieran citadas en el territorio
peninsular. Como resultado, 50 especies fueron seleccionadas y todas las citas
para estas especies fueron extraídas usando el formato Darwin Core.
Tras revisar todas las citas y eliminar los duplicados, se
extrajo la información relativa a la colección o conjunto de datos del que
procede el registro (collectionCode), la ocurrencia de la especie registrada
(occurrenceID), las personas, grupos u organizaciones responsables del registro
(recordedBy), la fecha en la que la especie fue registrada (eventDate), el
hábitat (hábitat), provincia (stateProvince) y localidad (locality) donde la
especie fue registrada, y el rango de altitud (minimum and maximum elevation),
longitud y latitud donde se realizó el registro (decimal latitud and longitud).
En concreto, los campos que aportan información sobre las características de la
autoecología de las especies son los relacionados con el hábitat y la
localidad. Dado que nuestro objetivo es determinar la especificidad que pueda
tener cada una de las especies por los hábitats de agua dulce y que, en
numerosas ocasiones, el campo “hábitat” estuvo ausente o incompleto, se
completó la búsqueda con referencias bibliográficas relacionadas con esa cita
en particular usando los diferentes censos de líquenes del territorio
peninsular y algunos trabajos más recientes (p.e. Álvarez
et al. 2001; Llimona y Hladun 2001; Burgaz 2006; Pérez-Ortega
y Álvarez-Lafuente 2006; Valcárcel y López de Silanes 2010; Romero y
Navarro-Rosinés 2021). Por último, para completar la información relativa a
las 50 especies de líquenes anfibios seleccionados, se incorporó el material
recolectado por nosotros en las provincias de Ciudad Real y Toledo e incluido
recientemente en el herbario MACB.
Resultados
Los resultados indican un desconocimiento importante de los
líquenes asociados a cursos de agua dulce, ya que existen pocas citas y la
mayoría proceden del tercio norte peninsular (Anexo I).
Las especies más abundantes son Catillaria chalybeia, Buellia spuria
y Pseudosagedia chlorotica, de mayor amplitud ecológica, que aparecen
con frecuencia en zona terrestre (Zona C). Las especies más escasas son Pseudosagedia
guentheri citada en el Parque Natural de Redes (Asturias), Polyblastia
quartzina, en Pirineos (Huesca) y Montes de Toledo (Toledo) o Pyrenocollema
saxicola en el río Visuña (Lugo) y Redes (Asturias) (Tabla
1, Anexo I).
Tabla
1. Listado de especies con indicación de
las zonas (bandas) de preferencia. A: zona regularmente sumergida; B:
zona inmersa en las crecidas, inundada regularmente después de las lluvias, y
cuando no están inmersos, están humedecidos por aerosol del agua; C: zona
terrestre, sujeta a inundaciones episódicas después de fuertes lluvias y agua
de escorrentía. Se indica también el número de citas obtenidas del nodo GBIF
España, indicando el tipo de hábitat (fluvial – Fluv– y terrestre –Terr–), el
rango altitudinal, y el número de provincias referenciadas (Provs).
Table
1. List of species indicating their preferred zones
(bands). A: regularly submerged; B: immersed during floods, regularly inundated
after rainfall, and when not submerged, moistened by water spray; C:
terrestrial zone subject to episodic flooding after heavy rain and runoff. The
number of records obtained from GBIF Spain is provided, indicating the type of
habitat (fluvial – Fluv– and terrestrial –Terr–), altitudinal range, and number
of referenced provinces (Provs).
Son muy pocos los grupos taxonómicos representados (a nivel
de familia), y el más frecuente es de las Verrucariaceae que incluye al 56% de
las especies (Anexo I). En cuanto al tipo de
reproducción, el 72% de las especies desarrolla peritecios, aumentando el
porcentaje al 86% si consideramos a las especies de zonas regularmente
sumergidas y a las de zonas sumergidas durante las crecidas (zonas A y B,
respectivamente).
A pesar del escaso número de registros para una gran parte
de las especies, especialmente para las 36 especies asociadas a las zonas A y
B, podemos observar un amplio rango altitudinal (Tabla 1),
y gran parte de las citas (salvo en Galicia principalmente) se corresponden con
zonas situadas por encima de los 1300 m de altitud (Fig.
1).
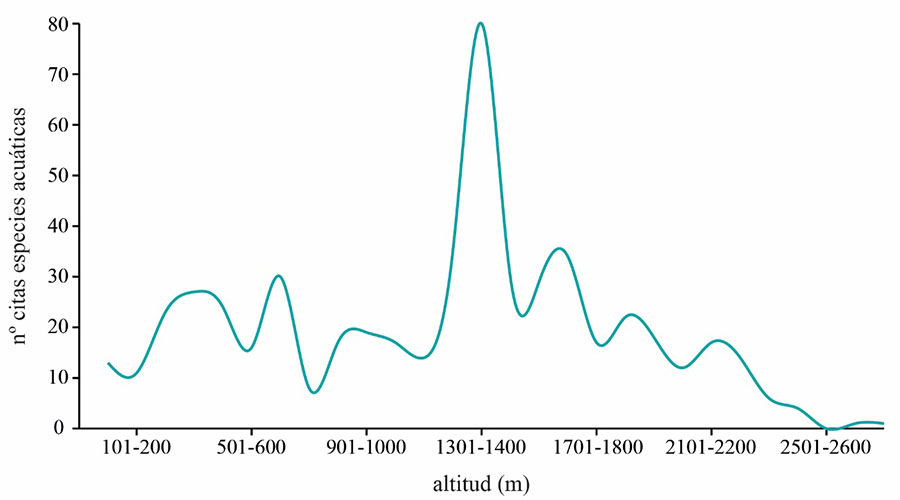
Figura 1. Distribución altitudinal del número total
de citas ligadas a hábitat fluviales (539 citas).
Figure 1.
Altitudinal distribution of the total number of records linked to fluvial
habitats (539 records).
Los resultados apuntan
también a una fuerte especificidad de las especies por el medio acuático,
especialmente de las especies que aparecen mejor representadas en las zonas A y
B. Las especies que van a estar mejor adaptadas a zonas con periodos de
inundación más largos y constantes (zonas A y B), van a estar prácticamente
ausentes en el medio terrestre (Tabla 2). Sin embargo, las especies adaptadas a vivir en zonas donde las
inundaciones son episódicas (zona C), aparecen con mayor frecuencia en medios
terrestres (Tabla
2).
Tabla 2. Distribución de las especies en función de las zonas
(bandas) de preferencia. Se indica el porcentaje de citas asociadas a medios
fluviales frente a terrestres.
Table 2. Species distribution according to the
different zones (bands). The percentage of records associated with fluvial
versus terrestrial environments is indicated.
Discusión
La mayoría de los líquenes anfibios
que están en contacto directo con el agua ya sea porque estén regularmente
sumergidos o porque parte del año estén bajo la influencia de las salpicaduras,
muestran una gran especificidad por el medio acuático, estando ausentes del
medio terrestre. Si a ello le añadimos las preferencias de hábitat y
ambientales, como la presencia de superficies rocosas amplias, estables y poco
erosionables, luz suficiente, pH > 5 o ausencia de eutrofización (p.e. Gilbert y Giavarini 1997; Nascimbene y Nimis 2006; Nascimbene et al. 2013; Thüs
et al. 2014), los cursos de agua temporales de zonas de montaña cobran una gran
importancia en la supervivencia de estas especies.
Gran parte de los líquenes anfibios
que viven en las zonas A y B van a estar expuestos a largos periodos de
inmersión que alternan con periodos de desecación más o menos variables (Gilbert y Giavarini 1997; Hawksworth 2000; Thüs et al.
2014) que, en las montañas mediterráneas, coinciden con la época estival de
mayor insolación y de temperaturas más elevadas (Nascimbene et al. 2023). Estos líquenes son
altamente especializados y su respuesta al secado y rehumedecimiento es una
característica clave para la supervivencia en su hábitat (Richardson 1993; Gilbert
y Giavarini 1997; Hawksworth 2000). Sin
embargo, este grupo de líquenes anfibios es muy sensible a desecaciones
prolongadas y difícilmente podrían desarrollarse en ambientes terrestres (Thüs et al. 2014).
La biota de
líquenes en hábitats fluviales se compone principalmente de formas de
crecimiento crustáceas delgadas, que facilitan el intercambio de gases y tienen
una alta densidad de fotobiontes para mejorar el equilibrio entre el consumo de
hidratos de carbono por respiración y las ganancias fotosintéticas (Thüs et al. 2014). Estos fotobiontes son esenciales para
la tolerancia de los líquenes a las inundaciones (Hawksworth
2000) de forma que, muchos líquenes terrestres o de hábitats semiacuáticos con
fotobiontes no especializados se "ahogan" cuando se exponen a
períodos prolongados de inmersión (Thüs et al. 2014).
Así, unos pocos líquenes dentro de la familia
Verrucariaceae, han desarrollado compatibilidad con algunos géneros de algas
típicos del medio acuático como Dilabifilum o Heterococcus (Thüs 2002; Thüs et al. 2011).
Estos líquenes no solo son tolerantes a la inundación permanente, sino que
también tienen una tolerancia muy limitada a la desecación (Hawksworth 2000; Thüs 2002; Coste et al. 2016). Otra de las características que
presentan la mayoría de las especies que viven en las zonas A y B, que sufren
mayores periodos de inmersión, es la presencia de peritecios como estructura de
reproducción sexual. Según Aptroot & Seaward
(2003) los peritecios son más resistentes al flujo de agua que los
apotecios, ya que ofrecen una mayor protección al himenio dentro de su
estructura cerrada y esférica.
Además, la sedimentación y la
eutrofización son dos factores importantes que van a afectar a estos líquenes
anfibios (Thüs 2002). Por un lado, la sedimentación
limita el crecimiento de las especies de líquenes, interfiriendo en la
penetración de la luz y actuando con efecto mecánico cuando cubre los talos de
estos líquenes crustáceos (Gilbert y
Giavarini 1997; Thüs 2002), siendo más sensibles
las especies con talos subgelatinosos que las que desarrollan talos más gruesos
y areolados (Nascimbene et al. 2013). Por otro
lado, los sólidos en suspensión van a favorecer las cubiertas de algas
filamentosas, limo, lodo y ciertas especies de briófitos (Gilbert y Giavarini 1997), dejando poco
espacio disponible para el desarrollo de los líquenes, que van a ser escasos y
muy efímeros (Gilbert y Giavarini 1997).
¿Por qué la relevancia de
ríos temporales y arroyos efímeros de montaña?
La degradación de los ecosistemas
fluviales es un problema histórico relacionado con su uso como fuente de
recursos y como vías para la eliminación de residuos (Alonso y Camargo 2005). Algunos de los principales
problemas que presentan estos ecosistemas están vinculados a la contaminación
por materia orgánica y la eutrofización por uso de fertilizantes nitrogenados
que provienen de una agricultura intensiva (Alonso
y Camargo 2005; Silva et
al. 2017; García y Miranda 2018), y que
van a constituir los principales inconvenientes para el desarrollo de los
líquenes anfibios (p.e. Gilbert y Giavarini
1997; Nascimbene et al. 2013; Thüs et al. 2014). Además, los
cultivos forestales realizados durante la segunda mitad del siglo XX han
intensificado los procesos erosivos, produciendo en muchos casos la colmatación
de cauces de ríos y arroyos en zonas mediterráneas a menor altitud (Sousa et al. 2010), eliminando por completo el hábitat
potencial para los líquenes anfibios.
En este sentido, las partes altas
de los ríos, arroyos y torrentes, donde la velocidad de la corriente es mayor y
apenas existen contaminación y eutrofización, se configuran como puntos clave
para la colonización y supervivencia de las especies de líquenes anfibios. De
hecho, aunque para el conjunto de especies estudiadas el rango altitudinal es
amplio, una gran parte de las citas obtenidas del nodo de GBIF España, proceden
de arroyos, torrentes y ríos de montaña, situados por encima de los 1300 m de
altitud (Cordillera Pirenaica, Cordillera Cantábrica, Sistema Ibérico, Sierra
Nevada) y regidos por una gran estacionalidad y variabilidad inter e
intra-anual. Estos datos estarían en consonancia con los apuntados por otros
autores para Europa, que muestran que la diversidad es más elevada en zonas de
media y alta montaña, determinada principalmente por la calidad del agua (p.e. Nascimbene y Nimis 2006; Krzewicka et al. 2020).
Sin embargo, los principales
problemas a los que se enfrentan estos líquenes anfibios son los derivados del
cambio climático y el uso del agua por el ser humano. Los ecosistemas acuáticos
continentales más afectados por el cambio climático son los ríos y arroyos de
montaña, con una gran dependencia de las precipitaciones anuales y/o
estacionales (Álvarez Cobelas et al. 2006).
En el contexto actual de cambio global, con aumento continuo de las
temperaturas, y un incremento del riesgo de sequía en la región mediterránea (IPCC 2019), se espera una
reducción considerable del caudal que provocaría la transición de ríos
permanentes a estacionales, mientras que otros muchos desaparecerán (Álvarez Cobelas et al. 2006).
Además, el cambio climático puede
interactuar con otros factores de estrés para las especies como diferentes
tipos de contaminantes o la radiación ultravioleta, por lo que podemos observar
tanto efectos directos como indirectos derivados de este proceso (Blaustein et al. 2010). Esto es especialmente
acuciante en las montañas mediterráneas donde el efecto del cambio climático y
un mayor uso del agua podría reducir considerablemente el hábitat de gran parte
de estas especies, determinado por la estrecha afinidad que tienen estos
líquenes anfibios por estos ecosistemas acuáticos.
Conclusiones
Dada la especificidad que tienen los líquenes anfibios por
el medio acuático, especialmente ligada a necesidades ambientales como la
estabilidad del sustrato y ausencia de eutrofización, los cursos de agua de
montaña concentran una mayor diversidad de líquenes. Estas restricciones hacen
que sean un grupo muy vulnerable al cambio climático, ya que estos ríos y
arroyos de montaña presentan una gran dependencia de las precipitaciones.
Contribución de los autores
Gregorio Aragón: Conceptualización, Investigación,
Metodología, Redacción – borrador original, Redacción – revisión y edición,
Supervisión, Validación. Patricia Pineros: Investigación, Metodología,
Validación. Marina Vicente: Investigación, Redacción – borrador original. Gil
Fernando Giménez: Investigación. Pilar Hurtado: Investigación, Metodología,
Redacción – borrador original, Redacción – revisión y edición, Visualización.
Agradecimientos
P.H. posee una ayuda postdoctoral "Margarita
Salas" otorgada por el Ministerio de Universidades y financiada por el
programa Next Generation EU Recovery.
Referencias
Alonso, A., Camargo, J.A. 2005. Estado actual y perspectivas en el empleo de la
comunidad de macroinvertebrados bentónicos como indicadora del estado ecológico
de los ecosistemas fluviales españoles. Ecosistemas 14(3): 87-99.
Álvarez, J., Sánchez-Biezma, M.J., López de Silanes, M.E. 2001.
Lista de los líquenes y hongos liquenícolas de Galicia. Nova Acta Científica
Compostelana (Bioloxía) 11: 53-151.
Álvarez Cobelas, M., Catalán, J., García de Jalón, D. 2006. Impactos sobre
los ecosistemas acuáticos continentales. En:
Moreno, J.M. (ed.), Evaluación preliminar de los impactos en España por
efecto del cambio climático, pp. 113-146. Ministerio de Medio Ambiente y
Universidad de Castilla-La Mancha. Madrid,
España.
Aptroot, A., Seaward, M.R.D. 2003. Freshwater
lichens. Fungal Diversity Research Series 10: 101-110.
Blaustein, A.R., Walls, S.C., Bancroft, B.A., Lawler, J.J., Searle, C.L.,
Gervasi, S.S. 2010. Direct and Indirect Effects of Climate Change on Amphibian
Populations. Diversity 2:
281-313.
Boulton, A.J. 2003. Parallels and contrasts in the
effects of drought on stream macroinvertebrate assemblages. Freshwater Biology 48:1173-1185.
Burgaz, A.R. 2006. Checklist of lichenized and lichenicolous fungi
of Madrid Community (Spain). Flora Mediterranea 16: 57-110.
Carcavilla, L., Díez-Herrero, A., Gegas, J. 2017. Monitorización en
cascadas y saltos de agua para la valoración de su “espectacularidad o belleza”
y sus implicaciones para su uso público. El caso de la chorrera de los
Navalucillos. En: Carcavilla, L., Duque-Macías, J., Giménez, J., Hilario, A., Monge-Ganuzas,
M., Vegas, J., Rodríguez, A. (eds.) Patrimonio geológico, gestionando la
parte abiótica del patrimonio natural, pp. 149-154. Cuadernos del Museo
Geominero 21. Instituto Geológico y Minero de España. Madrid, España.
Castroviejo, S.
(coord. gen.), 1986-2012. Flora ibérica 1-8, 10-15, 17-18, 21. Real
Jardín Botánico, CSIC. Madrid, España.
Cid, N., Verkaik,
I., García-Roger, E.M., Rieradevall, M., Bonada, N., Sánchez-Montoya, M.D.M.,
et al. 2016. A
biological tool to assess flow connectivity in reference temporary streams from
the Mediterranean Basin. Science of the Total Environment 540: 178-190.
Coste, C. 2010. New ecology and new classification for
phytosociology of hydrophilic lichens in acid watercourses in France. Acte du colloque des 3 èmes
rencontres Naturalistes de Midi-Pyrénées, 157–168.
Coste, C., Chauvet, E., Grieu, P., Lamaze, T.
2016. Photosynthetic
traits of freshwater lichens are consistent with the submersion conditions of
their habitat. Annales de Limnologie-International Journal of Limnology
52: 235-242.
Datry, T., Bonada, N., Boulton, A. J. 2017. General Introduction.
Intermittent Rivers and Ephemeral Streams. En: Datry,
T., Bonada, N., Boulton, A. J. (eds.) Intermittent Rivers and Ephemeral
Streams: Ecology and Management, pp. 1-20. Academic Press, Cambridge, Reino
Unido.
Gallart, F., Llorens, P., Latron, J., Cid, N., Rieradevall, M.,
Prat, N. 2016. Validating
alternative methodologies to estimate the regime of temporary rivers when flow
data are unavailable. Science
of the Total Environment 565:
1001-1010.
García, F., Miranda, V. 2018. Eutrofización, una amenaza para el recurso
hídrico. Universidad Autónoma Estado México UAEM, México. Disponible en: http://ru.iiec.unam.mx/4269/
Gilbert, O.L. 1996. The lichen vegetation of chalk and limestone
streams in Britain. The Lichenologist 28(2): 145-159.
Gilbert, O.L., Giavarini, V.J. 1997. The lichen
vegetation of acid watercourses in England. The Lichenologist 29(4):
347-367.
Gilbert, O.L., Giavarini, V.J. 2000. The lichen
vegetation of lake margins in Britain. The Lichenologist 32(4): 365-386.
Hachulka, M. 2011. Freshwater lichens on submerged stones and alder
roots in the Polish lowland. Acta Mycologica 46(2): 233-244.
Hawksworth, D.L. 2000. Freshwater and
marine lichen-forming fungi. Fungal Diversity 5:
1-7.
IPCC. 2019. Informe
especial del IPCC. Calentamiento global de 1,5ºC. Grupo Intergubernamental de
expertos sobre cambio climático. Disponible en: https://www.ipcc.ch/site/assets/uploads/sites/2/2019/09/IPCC-Special-Report-1.5-SPM_es.pdf
Keller, C., Scheidegger, C. 1994. Zur Verbreitung von Wasserflechten in Abhängigkeit
zur jährlichen Überflutungsdauer im Flüelatal (Schweiz, Kanton Graubünden). Herzogia 10: 99-114.
Krzewicka, B., Galas, J. 2006. Ecological notes on Verrucaria
aquatilis and V. hydrela in the Polish Tatry Mountains. En: Lackovičová, A., Guttová, A., Lisická, E., Lizoň, P. (eds), Central European lichens–diversity and
threat, pp. 193-204. Mycotaxon
Ltd. Ithaca, NY, EEUU.
Krzewicka, B., Smykla, J., Galas, J., Śliwa, L. 2017.
Freshwater lichens and habitat zonation of mountain streams. Limnologica
63: 1-10.
Krzewicka, B., Matura, N., Adamska, E., Osyczka, P.
2020. Species composition of freshwater lichens in temperate mountain streams:
the effect of site, habitat and local spatial isolation. Preslia 92(3):
235-254.
Larned, S.T., Datry, T., Arscott, D.B., Tockner, K. 2010. Emerging
concepts in temporary‐river ecology. Freshwater Biology 55(4): 717-738.
Llimona, X.,
Hladun, N.L. 2001. Checklist
of the lichens and lichenicolous fungi of the Iberian Peninsula and Balearic
Islands. Bocconea 14:
5-581.
Nascimbene, J.,
Nimis, P.L. 2006. Freshwater
lichens of the Italian Alps: a review. Annales de Limnologie-International
Journal of Limnology 42(1): 27-32.
Nascimbene, J., Thüs, H., Marini, L., Nimis, P.L. 2007. Freshwater lichens in springs
of the eastern Italian Alps: floristics, ecology and potential for
bioindication. Annales
de Limnologie-International Journal of Limnology 43(4): 285-292.
Nascimbene,
J., Thüs, H., Marini, L., Nimis, P.L. 2009. Early colonization of stone by freshwater
lichens of restored habitats: a case study in northern Italy. Science of the
Total Environment 407(18): 5001-5006.
Nascimbene, J., Nimis, P.L., Thüs, H. 2013. Lichens
as bioindicators in freshwater ecosystems-challenges and perspectives. Annali
di Botanica 3: 45-50.
Nascimbene, J., Nimis, P.L., Klüßendorf, J., Thüs,
H. 2023. Freshwater lichens, including new species in the genera Verrucaria,
Placopyrenium and Circinaria, associated with Lobothallia
hydrocharis (Poelt & Nimis) Sohrabi & Nimis from watercourses of
Sardinia. Journal of Fungi 9(3): 380.
Pereira,
I., Casares, M., Llimona, X. 1987. Aportación al conocimiento de los líquenes
hidrófilos de Sierra Nevada (Granada, S. de España). Cryptogamie, Bryologie
Lichénologie 8 (3): 263-273.
Pérez-Ortega, S., Álvarez-Lafuente, A. 2006. Primer catálogo de líquenes y
hongos liquenícolas de la Comunidad Autónoma de Castilla y León. Botanica complutensis 30: 17-52.
Richardson D.H.S. 1993. The physiology of drying and rewetting in
lichens. En: Jennings, D.H. (ed.), A Stress Tolerance of Fungi, pp.
275–296. Mycology series,
vol. 10. Marcel Dekker, New York, EEUU.
Romero, C.,
Navarro-Rosinés, P. 2021. Sobre la presència d’Hydropunctaria scabra a
la península Ibèrica, i notes sobre altres líquens aquàtics de Les Planes de
Son i mata de València. Butlletí de la Institució Catalana d´Història
Natural 85: 119-124.
Silva, A.R.E.,
Cobelas, M.Á., González, E.M. 2017. Impactos del nitrógeno agrícola en los
ecosistemas acuáticos. Ecosistemas 26(1): 37-44.
Sousa, A.,
Morales, J., García-Murillo, P., García-Barrón, L. 2010. Los arroyos costeros
de SW de España (manto eólico litoral onubense) como indicadores de cambios en
las tendencias de precipitación. Clima, ciudad y ecosistemas: ponencias y
conferencias invitadas al VII Coloquio de la Asociación Española de
Climatología 283-294.
Thüs, H. 2002. Taxonomie, Verbreitung und Ökologie silicoler
Süsswasserflechten im ausseralpinen Mitteleuropa. Bibliotheca Lichenologica
83: 1-214.
Thüs, H., Muggia,
L., Pérez-Ortega, S., Favero-Longo, S.E., Joneson, S., O’Brien, H., Nelsen,
M.P., et al. 2011. Revisiting
photobiont diversity in the lichen family Verrucariaceae (Ascomycota). European
Journal of Phycology 46(4): 399-415.
Thüs,
H., Aptroot, A., Seaward, M.R.D. 2014. Freshwater Fungi. En: Gareth Jones E.B., Hyde K.D., Pang,
K-L. (eds.), Freshwater
fungi and fungal-like organisms, pp. 333-358. De Gruyter, Berlin, Alemania.
Tooth, S. 2000. Process, form and change in dryland rivers: a
review of recent research. Earth-Science
Reviews 51(1-4): 67-107.
Valcárcel, C.P.,
Carballal, R. 2002. Líquenes
pirenocárpicos de los ríos y arroyos de Galicia (España). Cryptogamie, Mycologie 23(3): 245-271.
Valcárcel, C.P., López de Silanes, M.E. 2010. Especies
acuáticas del género Verrucaria s.l. (Ascomycetes liquenizados) en la Península
Ibérica. Nova Acta Científica Compostelana (Bioloxía) 19: 5-20.
Anexo/Appendix
Anexo 1. Listado de
especies con indicación de las estructuras de reproducción sexual y las
provincias (Península Ibérica). “Flora iberica” (Castroviejo 1986-2012)” fue seguida para las
abreviaturas de las provincias.
Appendix
1. Species list showing the structures of sexual
reproduction and the provinces (Iberian Peninsula). “Flora iberica” (Castroviejo 1986-2012) was followed for the provinces.
![]() , Patricia Pineros1
, Patricia Pineros1 ![]() , Marina Vicente2
, Marina Vicente2 ![]() , Gil
Fernando Giménez3
, Gil
Fernando Giménez3 ![]() , Pilar Hurtado1,4
, Pilar Hurtado1,4 ![]()
