Introducción
Los bosques secos son ecosistemas caracterizados por una
marcada estacionalidad en la distribución de las lluvias (Mooney et al. 1995). La temporalidad y duración de
los períodos secos depende en gran medida de la ubicación latitudinal. A medida
que aumenta la distancia al ecuador, el período seco se alarga y su incidencia
es más marcada en el invierno (Aguado y Burt 2014).
En el Chaco seco, la mayoría de los árboles son caducifolios, perdiendo sus
hojas en el período de sequía (otoño-invierno), esto posibilita una mayor
intensidad lumínica sobre el sotobosque, dando lugar al crecimiento y
desarrollo de herbáceas durante esta parte del año (Thomas y Baltzer 2002). En consecuencia, la
estacionalidad de lluvias en los bosques secos se convierte en una fuerza
ecológica dominante que determina, entre otras cosas, la apariencia y
distribución de la vegetación (Murphy y Lugo 1986).
Además, la configuración del paisaje de los bosques secos se ve modificada
constantemente por los altos niveles de alteraciones antrópicas y frecuentes
incendios forestales. Esto origina que la estructura de la vegetación alterne
entre bosque nativo, arbustos y sabanas (Murphy y
Lugo 1986; Miles et al. 2006).
Las especies de hormigas
que habitan los bosques secos, ambientes que se encuentran en continua
trasformación, responden a estos cambios modificando la estructura de sus
comunidades en términos de biodiversidad. Dicha estructura de las comunidades
de hormigas está determinada por diversas variables ecológicas como la
configuración del paisaje, estacionalidad climática, variación de temperatura y
precipitación, diversidad de la vegetación y variación de la cobertura del
dosel, lo que se encuentra profusamente documentado en la bibliografía
científica (Bestelmeyer 2000; Kaspari y Weiser
2000; Lindsey y
Skinner 2001; Kaspari 2003; Hann y Wheeler 2002; Ribas et al. 2003; Miranda et al. 2012; Neves et al. 2013; Montine et al. 2014; Silva et al. 2017).
Los bosques son hábitats tridimensionales donde los
organismos se distribuyen a lo largo de un gradiente vertical entre el suelo y
el dosel (Parker y Brown 2000; Basset et al. 2003). El número de estratos
verticales de vegetación varía con la latitud, de manera que en un bosque
húmedo tropical es posible encontrar más de cinco estratos (Basset et al. 2003), mientras que en un bosque seco
subtropical se distinguen generalmente tres estratos: suelo, sotobosque y dosel
(Terborgh 1985; Cabido
et al. 2018). En los estratos habitan diferentes comunidades de hormigas,
originando una estratificación vertical, tema ampliamente estudiado desde hace
décadas en los bosque húmedos (e. g. Longino
y Nadkarni 1990; Brühl et al. 1998; Yanoviak y Kaspari 2000; Basset et al. 2003; Hashimoto
et al. 2006; Ryder-Wilkie et al. 2010,
entre otros), pero escasamente documentado en bosques secos (e. g. Campos et al. 2008; Fontalvo y Martínez-Hernández 2010;
Neves et al. 2013; Marques
et al. 2017; Silva et al. 2017; Alves-Rodrigues et al. 2019).
Por lo expuesto, las características de la vegetación y la
estacionalidad climática de los bosques secos estructurarían a las comunidades
de hormigas. Hasta el momento existen pocos estudios sobre biodiversidad de
Formicidae en ambientes áridos o semiáridos (Amatta
et al. 2018; Pereyra et al. 2019). Entre
ellos, escasean los estudios centrados en la distribución espacial vertical de
hormigas en estos ambientes para latinoamérica, y no existe ninguno sobre la
zona estudiada. Es necesario
entonces buscar patrones de respuesta de las especies que permitan hacer
generalizaciones y comparaciones entre ambientes similares y que
evidencien cómo estos factores ecológicos impactan en su distribución. Es por
ello que el objetivo del presente trabajo fue estudiar cómo afecta la marcada
estacionalidad de los bosques secos en la estratificación vertical de hormigas
en dos fisonomías vegetales diferentes (bosque nativo y área abierta) de la
ecorregión del Chaco seco argentino.
Materiales y métodos
Área de estudio
El estudio se realizó en la localidad de Santos Lugares
(26°40'37''S - 63°35'31''W - 200 m.s.n.m), provincia de Santiago del Estero,
Argentina, en la región fitogeográfica del Chaco semiárido según Cabrera (1976), actualmente clasificada como
ecorregión del Chaco seco (Burkart et al. 1999; Brown y Pacheco 2006) que alberga uno de los
bosques secos más grandes de América (Portillo-Quintero
y Sanchez-Azofeifa 2010; Stan y
Sanchez-Azofeifa 2019; FAO y PNUMA 2020).
La ecorregión se caracteriza por un clima cálido,
predominantemente continental, de inviernos moderados y veranos calurosos. Las
temperaturas medias mensuales del verano son de 27 °C y de 16.3 °C en invierno.
Los extremos térmicos anuales oscilan entre 47 °C y -10.0 °C. Las
precipitaciones medias anuales son estimadas en 500 mm. Se destaca la marcada
estacionalidad de las lluvias, las cuales son moderadas durante la época
estival (octubre-marzo) y mínimas a nulas en el período invernal (abril –
septiembre) (Burkart et al. 1999; Boletta et al. 2006).
El bosque del Chaco seco está formado por especies arbóreas
xerofíticas y caducifolias que se alternan con pastizales, estepas halófitas y
sabanas (Cabrera y Willink 1980; Burkart et al. 1999). En el sitio de estudio se
distinguen dos tipos de fisonomías vegetales, las cuales se denominarán bosque
nativo y área abierta. La vegetación del bosque nativo se caracteriza por ser
un bosque primario xerófilo donde se observan tres estratos verticales de
vegetación. El estrato inferior compuesto por herbáceas, bromelias y cactáceas.
El estrato medio formado por arbustos, en su mayoría espinosos (e. g. Celtis
pallida Torrey, Acacia praecox Griseb., Capparis atamisquea
Kuntze y C. twediana Eichl.). Finalmente, el estrato superior dominado
por Aspidosperma quebracho-blanco Schlecht y Schinopsis lorentzii (Griseb.)
Engl. El área abierta es un remanente de bosque, donde se observan individuos
arbóreos aislados de Neltuma ruscifolia (Griseb.) C.E.
Hughes & G.P. Lewis. y Sarcomphalus mistol (Griseb.) Hauenschild.,
formando el estrato superior. No existe una clara división entre los estratos
inferior y medio, ya que ambos están constituidos por herbáceas anuales de
distintas alturas.
Diseño de muestreo y métodos de captura
En el bosque nativo y en el área abierta se
realizaron dos muestreos, uno durante la estación húmeda correspondiente al
verano (marzo) y otro durante la estación seca en invierno (julio) del año
2004.
Los sitios se encuentran distanciados por 1000 m. En ellos
se establecieron tres transectos de 100 m de largo, separados entre sí por 300
m aproximadamente. Cada técnica aplicada para la captura de hormigas fue
específica para cada estrato de acuerdo con sus características estructurales y
definidas previamente.
En el estrato inferior (EI) se utilizaron trampas de caída (pit
fall traps). Sobre cada transecto se ubicaron diez puntos de muestreos
separados por 10 m, en los cuales se dispusieron cuatro trampas de caída en las
esquinas de un cuadrado de 1 x 1 m. Las trampas consistieron en vasos plásticos
de 500 cc que contenían agua y jabón (Diodato 2005)
y estuvieron activas durante 48 horas, tiempo recomendado para la captura
eficiente de hormigas (Bestelmeyer et al. 2000;
Sarmiento 2003). Las cuatro trampas de caída por
punto de muestreo fueron unidas para ser consideradas como una sola muestra.
En el estrato medio (EM), tanto para el bosque nativo como
para el área abierta, se consideró la franja de vegetación comprendida entre
uno y dos metros sobre el nivel del suelo. En este estrato se capturaton las
hormigas empleando una red entomológica. Cada muestra se conformó mediante diez
golpes o pasaje de la red sobre los arbustos y herbáceas por punto separados
por 10 m, sobre el transecto original, totalizando 10 puntos de muestreo (Diodato 2005).
El estrato superior (ES) correspondió al dosel, es decir, a
partir de 4 m de altura en adelante. A lo largo de cada transecto, se
seleccionaron aleatoriamente diez árboles separados aproximadamente por 10 m
entre sí. En cada árbol se agitaron o golpearon las ramas del árbol
seleccionado y capturando todo el material con una red entomológica modificada
con mango telescópico para acceder a copas de los árboles. La unidad de
muestreo consistió en diez golpes en cada rama ubicadas en las cuatro
direcciones cardinales de la copa del árbol (Correa-Costa
et al. 1993; Diodato 1999, 2005).
Se obtuvieron en total en el área de estudio y durante las
estaciones estival e invernal 360 muestras, de las cuales 120 corresponden a
trampas de caída, 120 a red de arrastre y 120 a red de copa.
Los especímenes recolectados fueron colocados en frascos con
alcohol al 70% y correctamente etiquetados para su posterior identificación en
laboratorio. Para la identificación se utilizaron distintas claves taxonómicas
(e. g. Kusnezov 1978; Cuezzo
2000; Fernández 2003; Longino
2003; Wilson 2003, entre otras) y se comparó con
ejemplares de la colección del Museo del Instituto Fundación Miguel Lillo
(IFML, Tucumán, Argentina). Los ejemplares identificados fueron depositados en
el Instituto de Protección Vegetal de la Facultad de Ciencias Forestales
perteneciente a la Universidad Nacional de Santiago del Estero (Argentina).
Análisis de los datos
Para verificar la eficiencia de los muestreos se compararon
los valores totales de acumulación de especies, con el estimador no paramétrico
Jacknife de primer orden utilizando EstimateS 9.1.0. (Colwell
2013), con los valores obtenidos se graficaron las curvas de acumulación y
de estimación con el error estándar correspondiente.
La densidad de actividad (DA) (Kaspary
et al. 2022) y la riqueza específica (S) de hormigas, se determinó por
conteo directo de individuos y especies, respectivamente, para cada sitio,
estrato y estación climática. Se calcularon los índices de dominancia (D = Σ Pi) y
de Shannon-Wiener (H´ = - Σ Pi Ln(Pi)),
donde Pi es la proporción entre el número de individuos de la especie “i”,
y “n” el número total de individuos de la muestra (Magurran 2004).
Las diferencias significativas entre sitios fueron testeadas
mediante la prueba de Mann- Whithey y entre estratos con Kruskal-Wallis para
p<0.050, ya que no se pudo probar la normalidad de los datos mediante
distintas transformaciones.
Para comparar la composición de los ensambles de especies de
hormigas y determinar el grado de similitud entre estratos verticales
previamente definidos, se utilizó el índice cualitativo de Jaccard (Ij = c / a + b – c,
donde "a" es el número de especies en el sitio A, "b" es el
número de especies en el sitio B y "c" es el número de especies
presentes en ambos sitios), y el cuantitativo de Bray-Curtis (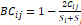 ,
donde Cij representa la suma de los menores valores obtenidos
para aquellas especies en común entre ambos sitios y los valores de Si
y Sj constituyen el número total de especímenes
contados en cada sitio). Estos índices varían entre 0 y 1, cuando los valores
son próximos a 0, se infiere que las comunidades son disímiles y cuando los
valores son cercanos a 1, son más similares entre sí (Magurran
2004).
,
donde Cij representa la suma de los menores valores obtenidos
para aquellas especies en común entre ambos sitios y los valores de Si
y Sj constituyen el número total de especímenes
contados en cada sitio). Estos índices varían entre 0 y 1, cuando los valores
son próximos a 0, se infiere que las comunidades son disímiles y cuando los
valores son cercanos a 1, son más similares entre sí (Magurran
2004).
Además, se realizó un
análisis de Escalamiento No-Métrico Multidimensional (NMDS) para estudiar la
existencia de diferencias entre los ensambles de Formicidae presentes en los
estratos verticales de cada sitio durante las estaciones de verano e inverno. La
existencia de diferencias fue testeada mediante un análisis multivariado
permutado de la varianza (PERMANOVA), con 10 000 permutaciones. Para ambos
análisis se utilizaron matrices con los valores de densidad de actividad y la
distancia de Bray-Curtis.
Todos los análisis mencionados fueron realizados con el uso
del software Past v. 4.03 (Hammer et al. 2001),
utilizando como unidad de muestreo el transecto.
Resultados
Se identificaron 43 especies de hormigas pertenecientes a 21
géneros y 7 subfamilias. Myrmicinae y Formicinae fueron las subfamilias con
mayor número de especies, 26 y 10 respectivamente. En toda el área de estudio
se recolectaron 4903 hormigas, siendo Linepithema micans (Forel) la
especie que presentó la mayor cantidad de individuos (Tabla
1).
El valor del estimador no paramétrico Jacknife fue igual a
53.690 (Fig. 1). Es decir que según el estimador
faltarían aproximadamente 11 especies de hormigas adicionales para completar la
capacidad de carga del área de estudio. Esto indica que los muestreos
permitieron recolectar el 80.089 % de las especies presentes.
El bosque nativo presentó
una mayor diversidad que el área abierta (H’ = 2.214), con una riqueza elevada
(S = 39), menor densidad de actividad (DA = 1486) y dominancia (D = 0.183). En
el área abierta el valor del índice de diversidad fue bajo (H’ = 0.514), por la
consecuente disminución en el valor de riqueza específica (S = 29) y aumento en
valores de densidad de actividad (DA = 3417) y dominancia (D = 0.829) respecto
al bosque nativo. De acuerdo con la prueba de Mann-Whithey no se observaron
diferencias significativas en los valores de densidad de actividad (p = 0.240),
riqueza específica (p = 0.365), dominancia (p = 0.699) y diversidad (p = 0.240)
obtenidos entre las fisonomías vegetales estudiadas.
Tabla 1. Hormigas presentes
en el bosque nativo y área abierta por estrato y estación climática en el Chaco
Seco Argentino. EI = estrato inferior; EM = Estrato medio; ES = Estrato
superior.
Table 1. Ants present in the native forest and open area by stratum and
climatic season in the Argentine Dry Chaco. EI = lower stratum; EM = Middle
stratum; ES = Upper stratum.
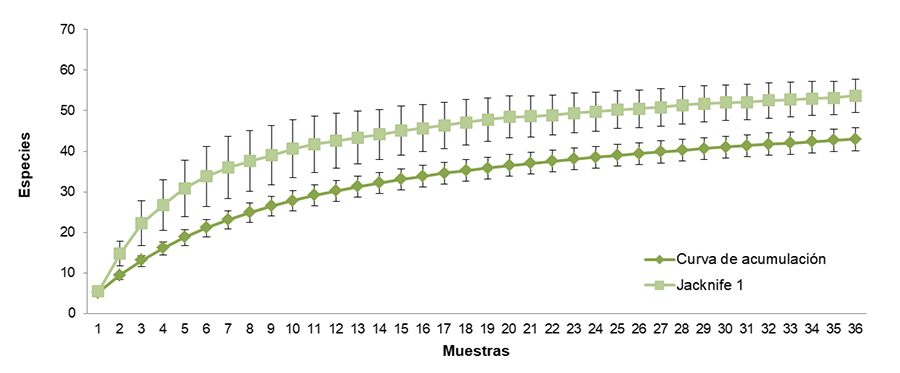
Figura 1. Curvas de acumulación y estimación de
especies, y error estándar para el área de estudio (Santiago del Estero, Argentina).
Figure
1. Species accumulation and estimation curves, and
standard error for the study area (Santiago del Estero, Argentina).
Efectos de la estacionalidad climática en la
estratificación vertical de hormigas en el bosque nativo
En la estación estival se recolectaron 1486 individuos y 39
especies de hormigas en el bosque nativo. Las siete subfamilias de hormigas
identificadas en total en el área de estudio estuvieron presentes en el estrato
inferior, mientras que en los estratos medio y superior solo se recolectaron
ejemplares de Myrmicinae y Formicinae (Tabla 1).
Las especies con mayor número de individuos fueron Pheidole jelskii Mayr
y Ectatomma brunneum F. Smith, presentes exclusivamente en el estrato
inferior. Los estratos medio y superior estuvieron dominados numéricamente por Brachymyrmex
Mayr.
En el invierno se recolectaron 128 ejemplares pertenecientes
a 13 especies incluidas en cuatro subfamilias (Myrmicinae, Dolichoderinae,
Formicinae y Ectatomminae). Todas estas especies estuvieron presentes en el
estrato inferior, mientras que en los estratos medio y superior solo se
recolectaron Myrmicinae y Formicinae. Con menor número de individuos
recolectados en la estación invernal las especies P. jelskii y E.
brunneum continuaron siendo las más frecuentes en el suelo, y Brachymyrmex
en los restantes estratos (Tabla 1).
Los mayores valores de densidad de actividad, riqueza
específica y diversidad durante la época estival fueron observados en el
estrato inferior (Fig. 2A, 2B y 2C). En el
estrato medio se obtuvo el mayor valor de dominancia (Fig.
2C), que se explica por la presencia numéricamente dominante de Brachymyrmex
patagonicus Mayr (Tabla 1). Según la prueba de
Kruskal-Wallis los valores de densidad de actividad, riqueza especifíca entre
los estratos fueron diferentes significativamente (H = 7.20 y p = 0.036,
respectivamente). Así también el valor de dominancia mostró diferencias
siginificativas (H = 5.60 y p = 0.050), mientras que los valores de diversidad
no presentaron diferencias.
En el muestreo invernal se
observó una disminución de la densidad de actividad y riqueza específica en el
estrato inferior de 93.356% y 29.412% respectivamente (Fig. 2A y 2B). Aun
así, este estrato sigue presentando el valor de diversidad más alto (Fig. 2C). Los
valores de densidad de actividad del estrato medio disminuyeron un 85.294%,
pero aún conservan el mayor valor de dominancia (Fig. 2D). Al igual que en el verano, en
el estrato medio se encontraron pocas especies (Tabla 1), de las cuales, B. patagonicus fue la
dominante en términos de número de individuos. Valores similares de densidad de
actividad, riqueza específica, dominancia y diversidad (Figs. 2A, 2B, 2C y 2D) para el
estrato superior se obtuvieron en ambos muestreos. Los índices calculados entre
los estratos para el invierno no son diferentes significativamente según la
prueba de Kruskal-Wallis.
Durante el verano, el bajo
número de especies compartidas (Tabla 2) y consecuentemente los bajos valores de índices de similitud indican
que los ensambles de hormigas presentes en los tres estratos son diferentes.
Entre ellos, los estratos medio y superior arrojaron valores mayores de
similitud, con menos cantidad de especies recolectadas, y compartidas en su
mayoría por ambos estratos. En el invierno los estratos inferior y medio
comparten una única especie, B. patagonicus, lo que originó los menores
valores de los índices de similitud. Estos valores fueron mayores en los
restantes estratos, que comparten más especies.
El PERMANOVA realizado (F = 3.488; p < 0.001) indica que
existen diferencias entre las distancias de las agrupaciones formadas en el
análisis NMDS (Fig. 3). Este análisis muestra un
claro distanciamiento entre los estratos durante una misma estación climática,
lo que infiere una clara estratificación de las hormigas en el bosque nativo.
De igual manera se observan distanciamientos entre los mismos estratos, pero en
estaciones diferentes, es decir que la estacionalidad impacta en la composición
de los estratos. Lo que confirma que la composición de los ensambles de
hormigas presentes en los estratos dentro de una misma estación y entre
estaciones son diferentes.
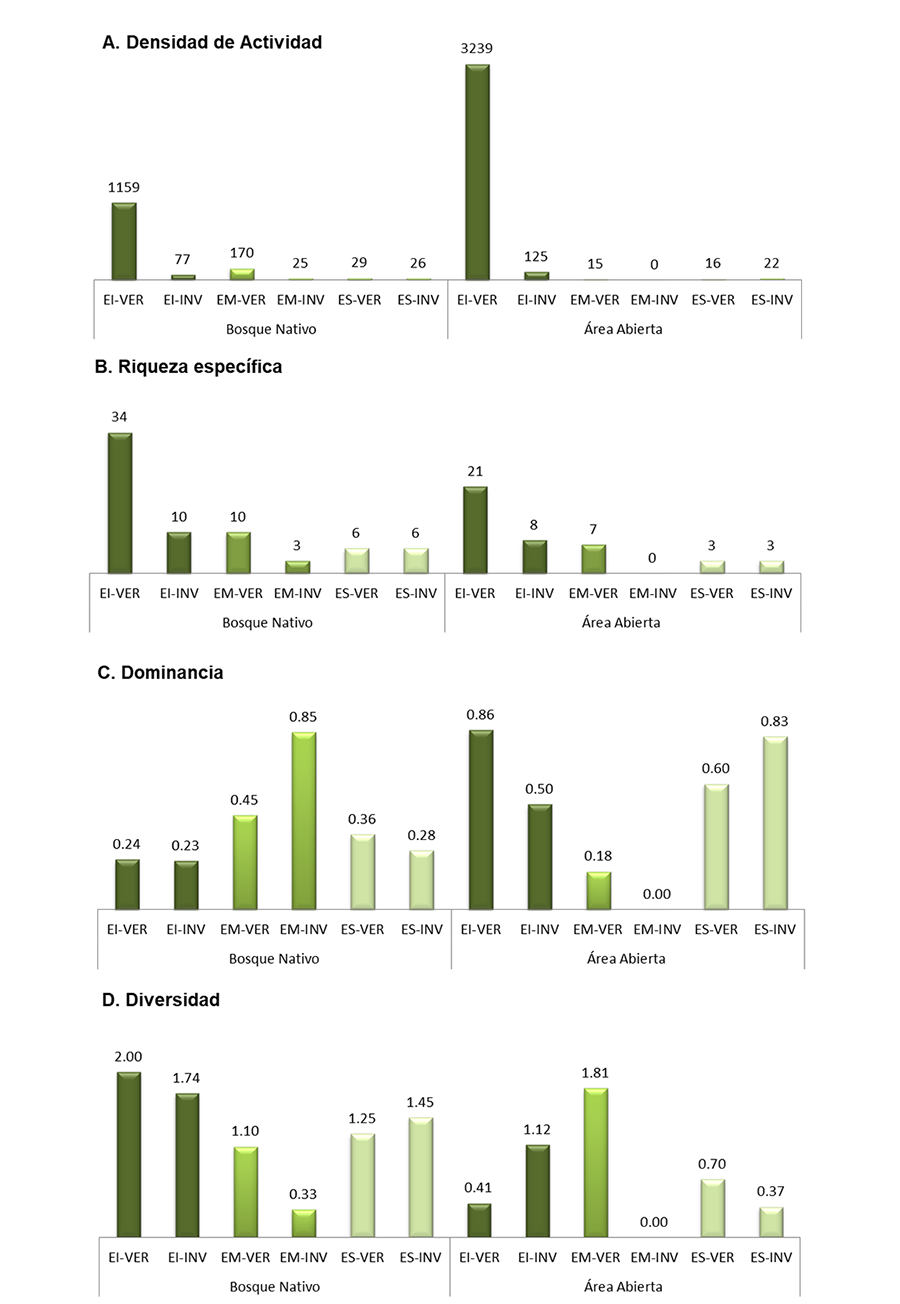
Figura 2. Valores de densidad de actividad (A),
riqueza específica (B), dominancia (C) y diversidad (D) de
hormigas registradas en el bosque nativo y área abierta por estación climática
y estrato (EI = Estrato Inferior; EM = Estrato Medio; ES = Estrato Superior) en
el Chaco Seco Argentino.
Figure 2. Activity density (A), species richness (B), dominance
(C) and diversity (D) values of ants recorded in the native
forest and open area by climatic season and stratum (EI = Lower Stratum; EM =
Middle Stratum; ES = Upper Stratum) in the Argentine Dry Chaco.
Tabla 2. Número de
hormigas observadas (Sp. Obs.) en cada estrato (EI = Estrato Inferior; EM =
Estrato medio; ES = Estrato Superior) del bosque nativo y del área abierta por
estación climática en el Chaco Seco Argentino; especies compartidas (Sp. comp.)
y valores de los índices de Jaccard y Bray-Curtis.
Table
2. Number of ants observed (Spp. Obs.) in each
stratum (EI = Lower Stratum; EM = Middle Stratum; ES = Upper Stratum) of the
native forest and the open area by climatic season in the Argentine Dry Chaco;
shared species (Spp. comp.) and values of the Jaccard and Bray-Curtis indices.
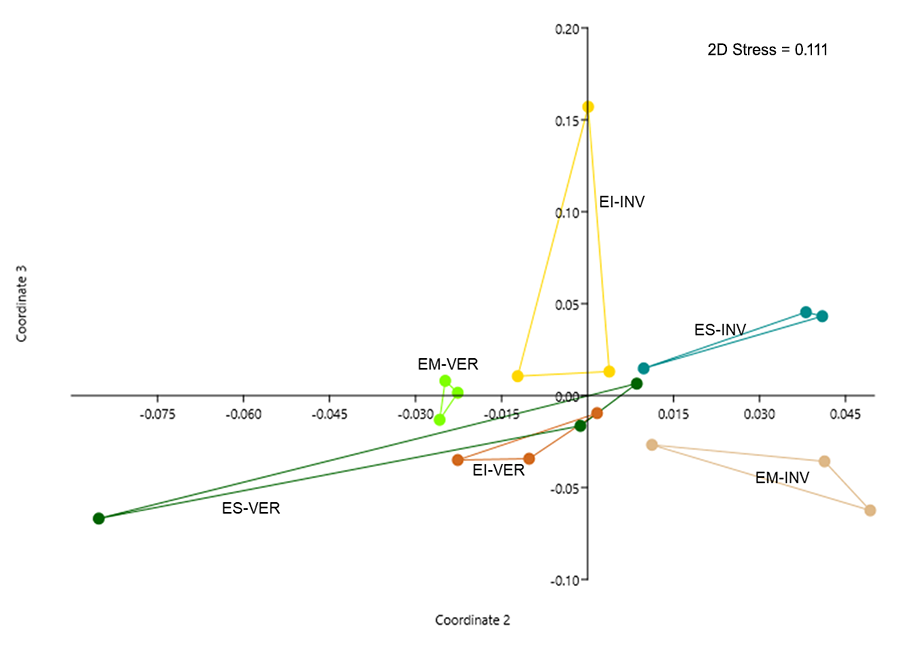
Figura 3. Análisis de Escalamiento No-Métrico
Multidimensional (NMDS), realizado con la matriz densidad de actividad de
hormigas encontradas en el bosque nativo durante el verano (VER) e invierno
(INV), en los estratos inferior (EI), medio (EM) y superior (ES), en el Chaco
Seco Argentino.
Figure 3. Non-Metric Multidimensional Scaling Analysis (NMDS), carried out
on the matrix of activity density of ants collected in the native forest during
summer (VER) and winter (INV), and in the lower (EI), middle (EM) strata. and
higher (ES), in the Argentine Dry Chaco.
Efectos de la estacionalidad climática en la
estratificación vertical de hormigas en el Área abierta
En el área abierta durante la estación estival se
recolectaron 3270 individuos y 27 especies de hormigas. Las siete subfamilias
identificadas en toda el área de estudio fueron recolectadas en el estrato
inferior del área abierta. En el estrato medio se identificaron especies de
Myrmicinae y Formicinae y en el estrato superior se sumó a las anteriores una
especie de Pseudomyrmecinae. En invierno se recolectaron 147 individuos
correspondientes a solo diez especies de hormigas de cuatro subfamilias (Tabla 1). En el estrato medio no se recolectaron
especies. En el estrato superior se identificaron individuos de Myrmicinae,
Formicinae y Dolichoderinae. La especie con mayor cantidad de individuos
recolectados fue L. micans en el estrato inferior durante ambas
estaciones, y en el invierno también fue abundante en el estrato superior.
Durante el verano el 99.05% de los individuos se capturaron
en el suelo (Fig. 2A). La riqueza específica
siguió el mismo patrón que en el bosque nativo, observándose que sus valores
disminuyeron a medida que ascendían los estratos verticales (Fig.
2B). La dominancia fue marcadamente superior en el suelo debido a los
altos valores de densidad de actividad de L. micans, lo que originó
valores bajos de diversidad en este estrato (Fig. 2C y 2D).
Según el análisis de Kruskal-Wallis solo el índice de riqueza específica mostró
diferencias significativas entre los estratos (H = 6.200, p = 0.014).
En el invierno se observó una fuerte disminución de la
densidad de actividad y la riqueza específica (95.50% y 62.96% respectivamente)
en el estrato inferior (Fig. 2A y 2B). El
mayor valor de dominancia de hormigas corresponde al dosel (Fig.
2C) y el mayor valor de diversidad al suelo (Fig.
2D). Todos los valores de los índices calculados presentan diferencias
significativas (riqueza específica: H = 7.200, p = 0.003; densidad de actividad
H = 7.200, p = 0.003; dominacia: H = 6.49, p = 0.007; diversidad: H = 6.20, p =
0.014).
En el área abierta y en ambas estaciones climáticas se
observan muy pocas especies compartidas entre estratos, consecuentemente los
valores de los índices de similitud son muy bajos (Tabla 2).
Las distancias observadas entre los distintos agrupamientos realizados por el
análisis NMDS fueron diferentes según los valores arrojados por el PERMANOVA (F
= 5.175; p < 0.001). En el NMDS se observa un claro distanciamiento entre
estratos para una misma estación climática, es decir que se observa una
estratificación de los formicidos en el área abierta. Así mismo se aprecia el
impacto de la estacionalidad en los distanciamientos entre los mismos estratos,
pero en diferentes estaciones climáticas (Fig. 4).
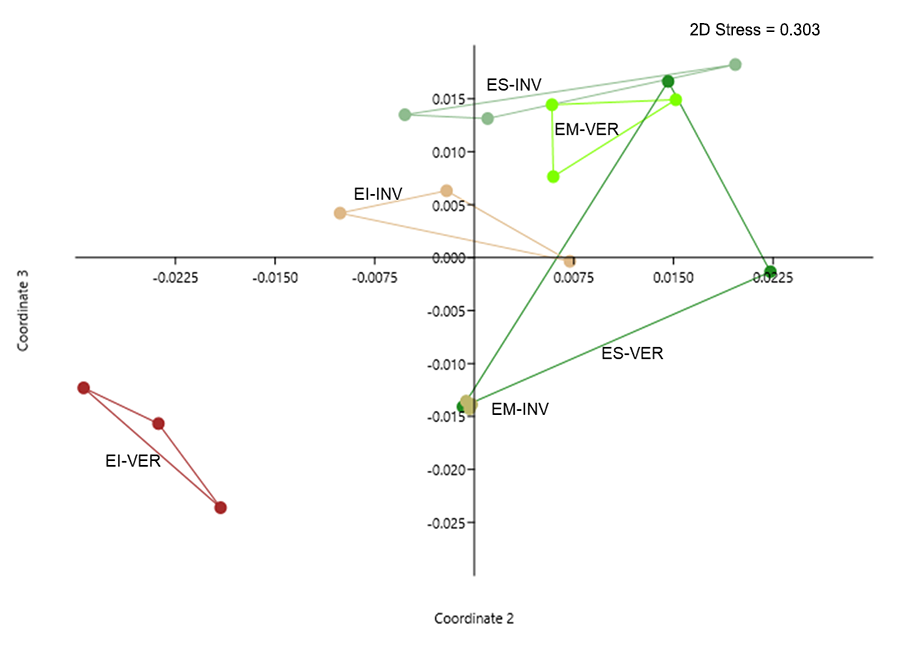
Figura 4. Análisis de Escalamiento No-Métrico
Multidimensional (NMDS), realizado con la matriz de densidad de actividad de
hormigas encontradas en el área abierta durante el verano (VER) e invierno
(INV), en los estratos inferior (EI), medio (EM) y superior (ES), en el Chaco
Seco Argentino.
Figure 4. Non-Metric Multidimensional Scaling Analysis (NMDS), carried out
on the matrix activity density of ants collected in the open area during summer
(VER) and winter (INV), and in the lower (EI), middle (EM) strata. and higher
(ES), in the Argentine Dry Chaco.
Discusión
Este trabajo constituye la primera contribución en cuanto a
los efectos de la estacionalidad climática sobre biodiversidad y la
estratificación de hormigas de bosques secos del Chaco argentino, región en que
la mirmecofauna ha recibido muy poca atención. Los resultados obtenidos son
comparables, en líneas generales, con los obtenidos en regiones áridas y
semiáridas similares (Andersen y Yen 1992; Campos et al. 2008; Fontalvo y Martínez-Hernández 2010;
Pereyra et al. 2019). Se brinda, información
básica y necesaria para emprender futuros estudios de la fauna de hormigas y se
aporta de manera indirecta al conocimiento de la distribución de Formicidae en
la Argentina.
A escala local, la biodiversidad de hormigas está asociada
positivamente con la heterogeneidad y complejidad de los hábitats que albergan
mayor disponibilidad de recursos (Hölldobler
y Wilson 1990; Bestelmeyer y Wiens 1996;
Armbrecht et al. 2004; Pacheco y Vasconcelos 2012). Los datos
obtenidos en el presente trabajo muestran que en el bosque nativo descrito se
recolectaron más especies y posee un mayor valor de diversidad. Al contrario,
en el área abierta se identificaron un menor número de especies y los valores
de dominancia y densidad de actividad fueron altos, por la gran cantidad de
individuos de L. micans. Las especies del género Linepithema son
nativas de una variedad de bosques, pastizales y hábitats montanos en América
Central y del Sur (Wild 2007). Entre ellas, es tal vez
la más conocida L. humile Mayr (hormiga argentina), por su
comportamiento altamente competitivo e invasor, en especial en sitios
perturbados (Tsutsui y Case 2001; Gordon y Heller 2014). Linepithema micans
forma parte del núcleo parafilético del complejo humile, donde comparten
muchas características comportamentales (Wild 2009) y
puede ser considerada una especie invasora como L. humile (Martins et al. 2012), lo que explicaría su densidad
de actividad en el área abierta.
En bosques húmedos tropicales se ha observado que las
hormigas ocupan equitativamente todos los estratos superiores de vegetación (Dejean et al. 2000; Armbrecht et al. 2001; Yanoviak et al. 2007), a diferencia de los
resultados obtenidos en este trabajo, donde las hormigas sí estuvieron
presentes en los tres estratos de ambos sitios, al menos durante el verano,
pero los mayores valores de riqueza específica, densidad de actividad y
dominancia se registraron a nivel del suelo. Si bien los resultados obtenidos
podrían estar sesgados por la selección de los métodos de muestreo empleados en
cada estrato, lo observado es consistente con otros estudios de zonas áridas y
semiáridas subtropicales, donde se demuestra que estos ambientes se
caracterizan por altos porcentajes de especies de hormigas epigeas (Andersen y Yen 1992; Campos
et al. 2008; Fontalvo y
Martínez-Hernández 2010). Estos resultados permitirían inferir que el suelo
de los bosques secos brinda condiciones ambientales más favorables para
anidación y mayor disponibilidad de recursos alimenticios para las hormigas (Kaspari 2003; Jaffé et al. 2007; Campos et al. 2008). En el dosel se encontró
una situación contrastante a la del suelo en términos de biodiversidad de
hormigas. Las copas de los árboles, que en el Chaco seco no forman una matriz
continua, sufren grandes fluctuaciones estacionales de humedad, velocidad del
viento, temperatura del aire, cantidad de luz y evapotranspiración, lo que
podría provocar cambios en las caracteristicas de la vegetación y
consecuentemente en los sitios de nidificación y la disponibilidad de recursos
para las hormigas como sucede en los bosques secos (Brühl
et al. 1998; Basset et al. 2003).
Uno de los factores que limitaría la existencia de una mayor
biodiversidad de hormigas en los estratos superiores del bosque seco es la
humedad. Las hormigas requieren altos valores de humedad debido a su pequeño tamaño,
lo que las hace susceptible a una rápida desecación (Kaspari y Weiser 2000; Kaspari
2003). De igual forma sucedería con los ensambles de hormigas presentes en
el estrato medio, donde los claros en el dosel producidos por la caducidad de
las hojas de los árboles originarían que el sotobosque quede expuesto a los
vientos y a una mayor insolación modificando la temperatura y la humedad (Widodo et al. 2001). Al comparar la
biodiversidad de hormigas presentes en los estratos medio y superior de las dos
fisonomías vegetales estudiadas, se observó que, en la vegetación continua del
bosque nativo, la densidad de actividad y diversidad de hormigas es mayor que
en las copas de los árboles aislados del área abierta y en la vegetación anual
del sotobosque. Por otra parte, las pocas especies que se registraron en el
dosel del área abierta demuestran que las hormigas también pueden encontrar y
utilizar recursos para el desarrollo de sus colonias en árboles aislados,
evidenciando el alto valor de conservación de estos en regiones semiáridas (Dunn 2000; Reyes-López et
al. 2003; Schonberg et al. 2004; Lőrincz et al. 2024).
Las dos fisonomías vegetales estudiadas a través del verano
e invierno se caracterizaron por una mayor riqueza específíca de Myrmicinae y
Formicinae en todos los estratos en los que las hormigas estuvieron presentes.
Resultados similares fueron obtenidos por otros autores en estudios realizados
en bosques secos (Lozano-Zambrano et al. 2009;
Fontalvo y Martínez-Hernández 2010).
En el dosel del área abierta también se observaron individuos de
Pseudomyrmecinae durante el verano y Doclichoderinae en el invierno. Las
especies de Pseudomyrmecinae son hormigas que anidan en ramas muertas o en
espinas (Ward 2003) utilizando los recursos del dosel
frecuentemente. Por ello se esperaría una mayor representatividad de estas
hormigas en los estratos superiores muestreados, sin embargo, esto no se
observó. Este resultado es consistente con otros trabajos realizados en bosques
húmedos tropicales (Chacon de Ulloa et al. 2014)
y en bosques secos (Fontalvo y
Martínez-Hernández 2010), donde la presencia de especies de
Pseudomyrmecinae es baja. Dolochoderinae estuvo representada por L. micans
en el dosel invernal del área abierta, esta especie es epígea y generalista (Wild 2007), probablemente en invierno fue obligada a
forrajear en el estrato superior por falta de recursos en el suelo y
sotobosque.
Se resalta la presencia de Brachymyrmex en los todos
los estratos de ambas fisonomías y durante ambas estaciones climáticas. Su
versatilidad para encontrar sitios de anidamiento, como así también por su
alimentación generalista (LaPolla y Longino
2006; MacGown et al. 2007) podrían explicar
el comportamiento de este género en los ambientes estudiados.
Se observa una clara diferencia en la densidad de actividad
y composición de especies del estrato inferior de cada fisonomía estudiada. En
el bosque nativo en ambas estaciones, fueron más abundantes P. jelskii y
E. brunneum, especies de hábitos alimenticios generalistas similares (Jaffé 1993; Arias-Penna 2007).
En el área abierta se observa que la densidad de actividad de L. micans
es muy alta y en menor escala Solenopsis saevissima (Smith), especie que
también posee comportamiento invasor en áreas perturbadas y con capacidad de
formar supercolonias (Martin et al. 2011).
Se comprueba que las variaciones de los factores climáticos
entre las estaciones del año no solo influyen en la distribución, desarrollo y
actividad de las hormigas como sugieren muchos autores (e.g. Kaspari y Weiser 2000; Hahn y Wheeler 2002; Jaffé
et al. 2007), sino que también modifican la distribución de la
biodiversidad entre los estratos verticales del bosque seco de la región
estudiada. Durante la estación invernal en el bosque nativo, se produjo una
disminución de los valores de diversidad en el suelo y contrariamente a lo
esperado, un aumento en los estratos medio y superior. Esto originó que no se
observaran diferencias significativas y que no se aprecie la estratificación de
la diversidad de hormigas. Probablemente, durante el invierno la disminución de
los recursos en el suelo, como ocurre en los bosques secos (Rico-Gray y Oliveira 2007), obligaría a las
hormigas epigeas a forrajear en el sotobosque y dosel. La distribución vertical
de la diversidad de hormigas del área abierta fue profundamente más afectada
por las variaciones estacionales. Durante la estación seca, el estrato medio formado
por herbáceas anuales desapareció, reduciéndose la estratificación a suelo y
dosel, y disminuyeron marcadamente los valores de riqueza especifíca, densidad
de actividad y diversidad.
Campos et al. (2008) aseguran
que la estratificación vertical de hormigas en ambientes áridos y semiáridos no
existe, ya que todas las especies que se encuentran en la vegetación
representan un subconjunto de las especies pertenecientes a los ensambles de
hormigas que anidan en el suelo. En este estudio, los bajos valores de
similitud entre estratos demuestran que la composición de hormigas es
diferente. Sin embargo, se observó que la mayoría de las especies capturadas en
el sotobosque y el dosel también están presentes en el suelo, coincidiendo con
las observaciones de los autores mencionados. Probablemente las especies
encontradas en todos los estratos se trasladen verticalmente a través de la
vegetación en busca de alimento (Longino y
Nadkarni 1990; Andersen y Yen 1992; Ribas et al. 2003; Ryder-Wilkie et al. 2010).
Conclusión
En el bosque nativo estudiado se obtuvieron los mayores
valores riqueza específica y diversidad de hormigas y en el área abierta los
mayores valores de densidad de actividad y dominancia, diferencias que no
pudieron ser probadas por la prueba estadistica, pero que muestran una clara
disparidad. Se observa una clara estratificación de la mirmecofauna en las
fisonomias vegetales estudiadas donde los mayores valores de densidad de
actividad, riqueza específica y diversidad se registraron a nivel del suelo.
Los cambios de las condiciones climáticas en las estaciones estival e invernal
influyen en la biodiversidad de formicidos de los estratos verticales de
vegetación. Estos resultados coinciden con los datos publicados por numerosos
autores, los cuales afirman que el suelo de los bosques secos proporciona las
mejores condiciones de hábitat para las hormigas, así también que los recursos
alimenticios y condiciones de nidificación se modifican como consecuencia de la
estacionalidad climática de los bosques secos; lo cual impacta directamente en
la mirmecofauna. Finalmente, cabe destacar que este estudio contribuye al mejor
conocimiento de la fauna de hormigas de bosques en ambientes áridos, que
constituyen cerca del 75% de los ambientes encontrados en la Argentina (Cabrera y WIllink 1980).
Contribución de los autores
Fuster, A.: análisis formal, conceptualización, curaduría de
datos, investigación, metodología, redacción del borrador original, revisión y
edición. Diodato, L.: administración del proyecto, adquisición de fondos y
recursos, conceptualización, investigación, metodología, revisión y edición,
supervisión. Cuezzo, F.: conceptualización, revisión y edición, supervisión.
Acceso a datos originales
Los datos originales de este trabajo se encuentran
depositados en el repositorio Zenodo.org y pueden ser accesados a través del
siguiente enlace: [https://doi.org/10.5281/zenodo.12668303]
Agradecimientos
Este trabajo fue subvencionado con fondos del proyecto:
Biodiversidad, conservación y uso sustentable del recurso fauna (insectos) en
el Chaco Semiárido. CICYT-UNSE 23/B086, y por la beca otorgada por el Consejo
Nacional de Investigaciones Científicas y Técnicas (CONICET - Argentina) a la
primera autora. Agradecemos profundamente a los revisores de la revista por sus
valiosas correcciones, las cuales han enriquecido significativamente la calidad
del trabajo.
Referencias
Aguado, E., Burt, J.E. 2014.
Understanding Weather and Climate. 7a ed. Pearson Education. Boston. USA. 608 p.
Alves-Rodrigues, C.,
Silva-Araújo, M., Rocha, E.C., Alves-Silva, D., Martinelli, N.M., Delabie,
J.H.C. 2019. Vertical stratification of ant assemblage in
Brazilian Savanna phytophysiognomies. Revista Bosque 40(3): 379 - 385.
Amatta, E. del V. , Calcaterra,
L.A. , Giannoni, S.M. 2018. Ant species (Hymenoptera:
Formicidae) in the three forests of the ischigualasto provincial park, a
protected area of the monte desert, Argentina. Society for Indonesian
Biodiversity 19 (3): 831 – 839.
Andersen,
A.N., Yen, A.L. 1992. Canopy ant communities in the
semi-arid mallee region of north-western Victoria. Australian Journal of.
Zoology 40: 205 - 14.
Arias-Penna,
T.M. 2007. Subfamilia Ectatomminae. En:
Jiménez, E., Fernández, F., Arias, T. M., Lozano-Zambrano, F. H. (Eds.). Sistemática,
biogeografía y conservación de las hormigas cazadoras de Colombia, pp.
53-107. Instituto de Investigación de Recursos Biológicos Alexander von
Humboldt. Bogotá, Colombia.
Armbrecht, I., Jiménez,
E.; Álvarez, G., Ulloa-Chacon, P., Armbrecht, H. 2001. An ant
mosaic in the colombian rain forest of Chocó (Hymenoptera: Formicidae). Sociobiología
37: 491 – 509.
Armbrecht, I., Perfecto, I., Vandermeer, J. 2004. Enigmatic biodiversity
correlations: ant diversity responds to diverse resources. Science
304(5668):284-6.
Basset, Y., Hammond, P.M., Barrios, H., Holloway, J.D., Miller, S.E. 2003.
Vertical stratification of arthropod assemblages. En: Basset, Y., Novotny, V.,
Miller, S.E., Kitching, R.L. (eds). Arthropods of Tropical Forests.
Spatio-temporal Dynamics and Resource Use in the Canopy, pp. 17-27.
Cambridge University Press, Cambridge, UK.
Bestelmeyer, B.T. 2000. The trade-off between thermal tolerance and
behavioural dominance in a subtropical South American ant community. Journal
of Arid Environments 69 (6): 998 - 1009.
Bestelmeyer,
B.T., Wiens, J. 1996. The effects of land use on
the structure of ground- foraging ant communities in the Argentinean Chaco. Ecological
Applications 6: 1225 - 1240.
Bestelmeyer, B., Agosti, D., Alonso, L., Brandao, C., Marrón, W., Delabie, J.,
Silvestre, R. 2000. Field techniques for the study of ground-dwelling ants. En:
Agosti, D., Majer, J., Alonso. L., Schultz, T. (Eds.), Ants, standard
methods for measuring and monitoring biodiversity, pp.122-144, Smithsonian.
Washington. USA.
Boletta, P.E., Ravelo, A.C., Planchuelo, A.M., Grilli, M. 2006. Assessing
deforestation in the Argentine Chaco. Forest Ecology and Management 228:
108 - 114.
Burkart, R., Bárbaro, N.O., Sánchez, R.O. Gómez D. A. 1999. Ecorregiones
de la Argentina, Administración de Parques Nacionales. Buenos Aires.
Argentina.
Brown, A.D., Pacheco S. 2006.
Propuesta de actualización del mapa ecorregional de la Argentina. En: Brown A.
D., Martínez Ortíz U., Acerbi M, Corcuera J. (eds), La Situación Ambiental
Argentina 2005, pp 28-31. Fundación Vida Silvestre Argentina. Buenos Aires,
Argentina.
Brühl, C.A., Gunsalam, G.,
Linsenmair, K.E. 1998. Stratification of ants (Hymenoptera,
Formicidae) in a primary rain forest in Sabah, Borneo. Journal of Tropical
Ecology 14: 285 - 297.
Cabido, M., Zeballos, S., Zak, M., Carranza, M., Giorgis, M., Cantero, J.,
Acosta, A. 2018. Native woody vegetation in central
Argentina: Classification of Chaco and Espinal forests. Applied
Vegetation Science. 21. https://doi.org/10.1111/avsc.12369
Cabrera, A. 1976. Regiones
fitogeográficas argentinas. En: Kugler, W.F. (Ed.), Enciclopedia argentina
de agricultura y jardinería, pp. 1-85, Tomo 2. 2a edición. Acme. Buenos
Aires. Argentina.
Cabrera, A., Willink, A.
1980. Biogeografía de América Latina. 2ª edición. Monografía 13.
Serie de Biología. Secretaría General de la Organización de los Estados
Americanos. Washington DC. EEUU.
Campos, R.I., Lopes, C.T,
Magalhães, W.C.S., Vasconcelos, H.L. 2008. Estratificação vertical de
formigasem Cerrado strictu sensu no Parque Estadual da Serra de Caldas Novas,
Goiás, Brasil. Iheringia. Série zoologica 98 (3) :311-316.
Chacón de Ulloa, P.,
Valdés-Rodríguez, S., Hurtado-Giraldo, A., Pimienta, M.C. 2014. Hormigas
arbóreas del Parque Nacional Natural Gorgona (Pacífico de Colombia). Revista de Biología Tropical 62(1): 277
- 287.
Colwell, R.K. 2013. EstimateS: statistical estimation of species richness
and shared species from samples. Version 9.1.0. [Accedido 20 diciembre
2018]. Disponible en: http://purl.oclc.org/estimates
Correa-Costa, E., Link,
C., Diodato, L. 1993. Indice de diversidade para entomofauna da bracatinga (Mimosa
scabrella Ben.). Ciencias Florestas 3 (1): 65-75.
Cuezzo, F. 2000. Revisión del
género Forelius (Hymenoptera: Formicidae: Dolichoderinae). Sociobiology
35 (2A):197 - 277.
Dejean, A., Mckey, D., Gibernau, M., Belin-Depoux, M. 2000. The arboreal
ant mosaic in a Cameroonian rainforest. Sociobiología 35: 403 -
423.
Diodato, L. 1999. Estudio de
las comunidades de coleópteros fitófagos (Curculionoidea) en áreas naturales y
repobladas de la región central de España. Tesis Doctorado. Escuela Superior de
Ingenieros de Montes. Universidad Politécnica de Madrid. España.
Diodato, L. 2005. Conservación
de la biodiversidad de atrópodos (Insecta) en ambientes naturales del Chaco
semiárido. En Giannuzzo, A., Ludueña, M, (Eds.), Cambios y problemas
ambientales- Perspectivas para la acción, pp. 205-224. Facultad de Ciencias
Forestales, Universidad Nacional de Santiago del Estero, Argentina.
Dunn, R.R. 2000. Isolated trees as foci of diversity in active and
fallow fields Biological Conservation, 95: 317-321
FAO y PNUMA 2020. El
estado de los bosques del mundo 2020. Los bosques, la biodiversidad y las
personas. Roma. [usado 8 diciembre 2022]. https://doi.org/10.4060/ca8642es
Fernández, F. (Ed.) 2003. Introducción
a las hormigas de la región Neotropical. Instituto de Investigación de
Recursos Biológicos Alexander von Humboldt, Bogotá, Colombia.
Fontalvo, R.,
Martínez-Hernández, N. 2010. Nueva técnica de captura para evaluar la
estratificación vertical de hormigas (Hymenoptera: Formicidae) en el bosque
seco tropical, Colombia. Boletín de la Sociedad Entomológica Aragonesa
46: 311−318.
Gordon, D.M., Heller, N.E.
2014. The invasive Argentine ant Linepithema humile
(Hymenoptera: Formicidae) in Northern California reserves: from foraging
behavior to local spread. Myrmecological News 19: 103-110.
Hahn, D.A.,
Wheeler, D.E. 2002. Seasonal foraging activity and
bait preference of ants on Barro Colorado Island, Panama. Biotrópica 34:
348 - 356.
Hammer, Ø., Harper, D.A.T., Ryan, P.D. 2001. Past: Paleontological
Statistics Software Package for Education and Data Analysis. Palaeontología
Electrónica 4: 1 - 9.
Hashimoto, Y., Morimoto,
Y., Widodo, E., Mohamed, M. 2006. Vertical Distribution
Pattern of Ants in a Bornean Tropical Rainforest (Hymenoptera: Formicidae). Sociobiology.
47. 697-710.
Hölldobler,
B., Wilson, E.O. 1990. The ants. Harvard
University Press, Cambridge, Massachusetts, USA.
Jaffé, K. 1993. El mundo de
las hormigas. Editorial Equinoccio. Ediciones de la Universidad Simón
Bolívar. Caracas, Venezuela.
Jaffé, K., Horchler, P.,
Verhaagh, M., Gómez, C., Sievert, R., Jaffe, R., Morawetz, W. 2007. Comparing the ant fauna in a tropical and a temperate forest canopy.
Ecotrópicos 20 (2): 74 - 81.
Kaspari, M. 2003. Introducción
a la ecología de las hormigas. En: Fernández, F. (ed.), Introducción a las
hormigas de la región Neotropical, pp. 97-112. Instituto de Investigación
de Recursos Biológicos Alexander von Humboldt, Bogotá, Colombia.
Kaspari,
M., Weiser, M. 2000. Ant activity along moisture
gradients in a Neotropical Forest. Biotrópica 32: 703 - 711.
Kaspari, M., Weiser, M.D., Marshall, K.E., Miller, M., Siler, C., De Beurs,
K. 2022. Activity density at a continental scale: What drives invertebrate
biomass moving across the soil surface? Ecology 103 (1): e03542. https://doi.org/10.1002/ecy.3542
Kusnezov, N. 1978. Hormigas
argentinas: clave para su identificación. Edición preparada por R. Golbach,
Fundación Miguel Lillo, Miscelánea 61. San Miguel de Tucumán. Argentina, 146
pp.
LaPolla, J.S., Longino,
J.T. 2006. Un nuevo e inusual Brachymyrmex Mayr de Costa Rica, con
implicaciones para la filogenia del grupo tribu lasiine. Actas de la
Sociedad Entomológica de Washington 108: 297-305.
Lindsey, P.A., Skinner,
J.D. 2001. Ant composition and activity patterns as
determined by pitfall trapping and other methods in three habitats in the
semiarid Karoo. Journal of Arid Environments 48: 551 - 568.
Longino, J.T. 2003. The Crematogaster of Costa Rica. Zootaxa 151: 1 - 150.
Longino, J.,
Nadkarni, N. 1990. A
comparison of ground and canopy leaf litter ants (Hymenoptera: Formicidae) in a
neotropical montane forest. Psique 97: 81 - 93.
Lőrincz, Á., Hábenczyus, A.A., Kelemen, A., Ratkai, B., Tölgyesi, C.,
Lőrinczi, G., Bátori, Z., et al. 2024. Wood-Pastures Promote Environmental and
Ecological Heterogeneity on a Small Spatial Scale. Science of The
Total Environment 906, 167510.
Lozano-Zambrano, F.,
Ulloa-Chacón, P., Armbrecht, I. 2009. Hormigas: Relaciones Especies-Área en
Fragmentos de Bosque Seco Tropical. Neotropical Entomology 38(1): 44-45.
MacGown, J.E., Hill, J.G., Deyrup, M. 2007. Brachymyrmex patagonicus
(Hymenoptera: Formicidae), an emerging pest species in the Southeastern United
States. Florida Entomologist 90: 457-464.
Magurran, A.E. 2004. Measuring biological diversity. Blackwell
Publishing. London, UK.
Martin, J.-M., Roux, O., Groc, S., Dejean, A., 2011. A type of
unicoloniality within the 735 native range of the fire ant Solenopsis
saevissima. Revista de Biológia Tropical 334: 307 - 310.
Martins, C., Nondillo, A.,
Martins, V., Botton, M. Bueno, O. 2012. Occurrence of Three
Haplotypes of Linepithema micans (Forel) (Hymenoptera: Formicidae) in
Southern Brazil. Neotropical entomology 41. 57-61.
Marques, T., Espírito-Santo,
M., Neves, F., Schoereder, J. 2017. Ant Assemblage Structure
in a Secondary Tropical Dry Forest: The Role of Ecological Succession and
Seasonality. Sociobiology 64.
Miles, L., Newton, A.C., DeFries, R., Ravilious, C., May, I., Blyth, S.,
Kapos, V., et al. 2006. A global overview of the conservation status of
tropical dry forests. Journal of Biogeography 491-505.
Miranda-Calle, A., Naoki, K., Limachi, M. L. 2012. Ensamble de hormigas en
relación a cobertura vegetal en una zona periurbana de La Paz (Bolivia). Ecología
en Bolivia. 47: 119-133.
Montine, P.S.M., Viana,
N.F., Almeida, F.S., Dáttilo, W., Santana, A.S., Martins, L., Vargas, A.B.
2014. Seasonality of epigaeic ant communities in a Brazilian
Atlantic Rainforest. Sociobiology 61(2): 178-183
Mooney, H.A., Bullock, S.H., Medina, E. 1995. Introduction. En: S.H.
Bullock, H.A. Mooney, E. Medina (Eds.), Seasonally dry tropical forests,
pp. 1–8. Cambridge University Press. Cambridge, UK.
Murphy, P.G.,
Lugo, A.E. 1986. Ecology of Tropical Dry Forest. Annual
Review of Ecology, Evolution, and Systematics 17:67-88.
Neves, F.S., Queiroz-Dantas,
K.S., Da Rocha, W.D., et al. 2013. Ants of Three Adjacent
Habitats of a Transition Region Between the Cerrado and Caatinga Biomes: The
Effects of Heterogeneity and Variation in Canopy Cover. Neotropical
Entomology 42, 258–268.
Parker, G.G,
Brown, M. J. 2000. Forest canopy stratification- is
it useful? American Naturalist 155: 473-484.
Pacheco,
R., Vasconcelos, H.L. 2012. Habitat diversity enhances ant diversity in a naturally
heterogeneous Brazilian landscape. Biodiversity and Conservation
21:797–809.
Pereyra, M., Pol, R.G., Galetto, L. 2019. Ant community patterns in highly
fragmented Chaco forests of central Argentina. Austral Ecology 44 (4): 668-679.
Portillo-Quintero,
C.A., Sánchez-Azofeifa, G.A. 2010. Extent and conservation of
tropical dry forests in the Americas. Biological Conservation 143:
144–155.
Reyes-López, J.L., Ruiz,
N., Fernandez Haeger, J. 2003. Community structure of
ground-ants: The role of single trees in a Mediterranean pastureland. Acta
Oecologica. 24. 195-202.
Ribas, C.R., Schoereder, J.H., Pic, M., Soares, S.M. 2003. Tree
heterogeneity, resource availability, and larger scale processes regulating
arboreal ant species richness. Austral Ecology 28: 305 - 314
Rico-Gray,
V., Oliveira, P.S. 2007. The Ecology and
Evolution of Ant-Plant. The University of Chicago Press, Chicago, USA. 331
pp.
Ryder-Wilkie, K.T., Mertl, A.L., Traniello, J.F.A. 2010. Species Diversity and
Distribution Patterns of the Ants of Amazonian Ecuador. PLoS One
5 (10): e13146.
Sarmiento, C.E. 2003.
Metodologías de captura y estudio de las hormigas. En: Fernández, F. (ed.),
Introducción a las hormigas de la región Neotropical, pp 201-210.
Instituto de Investigación de Recursos Biológicos Alexander von Humboldt,
Bogotá, Colombia.
Silva, L., Souza, R. Solar,
R. Neves, F. 2017. Ant diversity in Brazilian tropical dry
forests across multiple vegetation domains. Environmental Research Letters
12. https://doi.org/10.1088/1748-9326/aa5f2a
Schönberg, L., Longino, J.T. Nadkarni, N.M., Yanoviak, S.P. Gering, J.C.
2004. Arboreal ant species richness in primary forest, secondary forest, and
pasture habitats of a tropical montane landscape. Biotrópica 36:
402-409.
Stan, K., Sanchez-Azofeifa, G.A. 2019. Tropical Dry Forest Diversity,
Climatic Response, and Resilience in a Changing Climate. Forests. 10.
443. https://doi.org/10.3390/f10050443
Thomas,
S.C., Baltzer, J.L. 2002. Tropical forests. En:
Wiley, J., Sons (eds.). Encyclopedia of Life Sciences. Macmillan
Publishers Ltd., Nature Publishing Group.
Terborgh, J. 1985. The Vertical Component of Plant Species Diversity in Temperate and
Tropical Forests. American Naturalist 126: 760 - 776.
Tsutsui,
N.D., Case, T.J. 2001. Population genetics and
colony structure of the Argentine ant (Linepithema humile) in its native
and introduced ranges. Evolution 55(5): 976-985.
Ward, P.S. 2003. Subfamilia
Pseudomyrmecinae. En: Fernández, F. (ed.), Introducción a las hormigas de la
región Neotropical, pp. 331-333. Instituto de Investigación de recursos
Biológicos Alexander Von Humboldt, Bogotá, Colombia.
Widodo, E.S., Mohamed, M. Hashimoto, Y. 2001. Canopy ant diversity
assessment in the fragmented rainforest of sabah, east Malysia. Nature and
Human Activities 6: 13 - 23.
Wild, A.L. 2007. Taxonomic revision of the ant genus Linepithema
(Hymenoptera: Formicidae). University of California Press, Los Angeles, 162pp.
Wild, A.L. 2009. Evolution of the neotropical ant genus Linepithema. Systematic
Entomology 34(1):49–62
Wilson, E.O. 2003. The genus Pheidole in the New World: A dominant
hyperdiverse ant genus. Harvard University Press, Cambridge, 794pp.
Yanoviak,
S.P. Kaspari, M. 2000. Community structure and the
habitat templet: ants in the tropical forest canopy and litter. Oikos
89: 259 - 266.
Yanoviak, S.P., Fisher, B.L. Alonso, A. 2007. Arboreal ant diversity
(Hymenoptera: Formicidae) in a central African forest. Revista Africana de
Ecología 46: 60 - 66.
![]() , Liliana
Diodato1
, Liliana
Diodato1 ![]() , Fabiana Cuezzo2
, Fabiana Cuezzo2 ![]()



