Características del medio
subterráneo en Canarias
El medio subterráneo,
como biotopo habitable de forma permanente por seres vivos, tiene unas
características universales para cualquier ámbito geográfico: ausencia de luz,
gran estabilidad térmica e higrométrica y, dependiendo de la profundidad y
otros factores, una marcada escasez de materia orgánica, aunque haya ciertas
excepciones. El medio subterráneo incluiría, según ciertos autores, toda la
parte habitable de la litosfera por debajo de su superficie (ver Culver y Pipan
2019). Otro concepto más utilizado y al que nos
referiremos en este estudio, distingue entre el medio endogeo (= dentro de la
tierra), constituido por los horizontes A y B del suelo edáfico, y el medio
subterráneo propiamente dicho o medio hipogeo (= por debajo de la tierra), más
profundo, que incluye la roca madre y la parte superior más disgregada de la
misma (el horizonte C del suelo) (Juberthie
et al. 1980). El medio hipogeo es muy variado dependiendo de
muchos factores como el tipo de roca, su estructura, su origen, la profundidad,
etc. La red de espacios interconectados presentes en el medio condiciona su
habitabilidad, tanto por la porosidad que dará acceso al aire, al agua y a los
nutrientes necesarios para la vida, como por la existencia de espacios tales
que puedan ser ocupados por los seres vivos. El medio endogeo lo habitan seres
de pequeño tamaño (nematodos, ácaros, colémbolos, pequeños insectos) o bien
mayores pero capaces de abrir galerías en la tierra (lombrices de tierra,
vertebrados). En cambio, el medio hipogeo es más compacto y difícilmente
perforable. En este sentido, Howarth (1983) clasificó sus espacios internos en microcavernas (<0.1 cm),
mesocavernas (0.1 – 20 cm) y macrocavernas (>20 cm), estas últimas pudiendo
incluso albergar vertebrados. En el seno de la roca madre se encuentra el Milieu
Souterrain Profond de (Juberthie 1983) o Medio Subterráneo Profundo
(MSP), cuya red de grietas en macizos permeables como los calcáreos incluye los
tres tipos de espacios, siendo las macrocavernas lo que conocemos como cuevas
propiamente dichas. Por otro lado, a modo de interfase entre la roca madre
(permeable o no) y el suelo suele haber una capa de fragmentos de roca con sus
correspondientes espacios (meso y microcavernas) que constituyen el Milieu
Souterrain Superficiel de Juberthie
et al. (1980), o Medio
Subterráneo Superficial (MSS), también descrito como Upper Hypogean Zone por
Uéno (1980). El MSS también forma parte del medio hipogeo, y
puede tener distintos orígenes: meteorización (horizonte C del suelo),
coluvial, aluvial, volcánico, etc. (Mammola et al. 2016).
El medio hipogeo puede ser acuático (corrientes de agua
subterráneas, capa freática, zona intersticial, medio hiporreico) o terrestre.
Este último podrá albergar una fauna adaptada siempre que haya una red de
espacios adecuada, una humedad elevada y cierto aporte de materia orgánica, que
es casi exclusivamente alóctona dado que la oscuridad limita enormemente la
producción primaria in situ. Los medios hipogeos habitables más
extendidos mundialmente son los de terrenos calizos, sobre todo gracias a la
fácil karstificación de esta roca, pero se han descrito muchos otros distintos (Culver y Pipan 2019), entre los cuales figuran
los terrenos volcánicos (Howarth 1983; Oromí et al. 2021). La mayoría de características físicas y ambientales del
medio hipogeo volcánico son similares a las de cualquier otro, aunque hay
ciertas diferencias notables. Por un lado, las macrocavernas suelen ser tubos
volcánicos que, a diferencia de las cuevas kársticas, son de origen singenético
(formación rápida y simultánea de la oquedad y su roca encajante) (Montoriol 1973); tienen una vida media muy inferior,
normalmente menor de 500 000 años (Howarth 1983); son poco profundas y mejor conectadas
con hábitats de superficie; y pasan por una sucesión ecológica más veloz, que
progresa de zonas más profundas a más someras, a la inversa que en las
kársticas (Howarth 1996). Otras macrocavernas menos frecuentes
son las simas volcánicas, de mayor duración y mucho más profundas que los tubos
de lava, lo que permite el acceso al subsuelo en terrenos antiguos donde los
tubos ya han desaparecido (Martín
et al. 1985). Las minas artificiales
que se perforan bajo el cauce de barrancos son otro tipo de cavidades que
atraviesan capas subterráneas normalmente inaccesibles, y albergan una fauna
hipogea obligada tanto troglobionte (terrestre) como estigobionte (acuática) (Naranjo
et al. 2020). Los MSS presentes en
terrenos volcánicos, coluviales y de meteorización tienen un origen y unas
características idénticas a los de otros terrenos no volcánicos (Medina y
Oromí 1990; Pipan et al. 2010); pero hay otros exclusivos como el denominado MSS
volcánico, formado a partir de la escoria superficial de la lava cubierta
posteriormente por suelo edáfico (Oromí
et al. 1986); y los campos de
piroclastos, de habitabilidad casi inmediata al no precisar de un suelo como
recubrimiento superficial protector, gracias a la alta capacidad de retención
de humedad de estos depósitos (Oromí
et al. 2021). En Canarias los MSS de
meteorización y los coluviales se encuentran en terrenos antiguos con suelos
evolucionados, y el MSS volcánico y los campos de piroclastos en terrenos mucho
más modernos, poco meteorizados y con escasa o nula cobertura edáfica.
Las islas modernas como La Palma o El Hierro (>2 Ma)
tienen sobre todo tubos volcánicos, MSS volcánico y depósitos de piroclastos.
Las islas maduras (>8 Ma) pueden presentar solamente simas volcánicas y MSS
coluvial y de meteorización, como en La Gomera, que no ha tenido erupciones en
los últimos 2.8 Ma (Ancochea
et al. 2006); o también tubos de
lava, piroclastos y MSS volcánico si a pesar de su antigüedad han tenido
vulcanismo activo reciente o subreciente, como es el caso de Tenerife, Gran
Canaria, Fuerteventura y Lanzarote (Carracedo
et al. 1998).
Adaptaciones de la fauna a la vida subterránea
Los ambientes endogeos
suelen ser ricos en materia orgánica y su fauna está constituida por especies
pequeñas, ciegas y de apéndices cortos, conocidas por edafobiontes (Culver y Pipan 2019). En
ambientes hipogeos el alimento es generalmente mucho más escaso que en los
endogeos, resultando su supervivencia más ardua. Estos y otros factores han
condicionado que las especies animales que los habitan de forma obligada
(=troglobiontes) hayan adquirido, a lo largo de su evolución, unas adaptaciones
particulares para poder subsistir en un ambiente hostil. Estas transformaciones
(reducción o desaparición de órganos visuales, despigmentación corporal,
alargamiento de apéndices, ralentización del metabolismo, etc.) se conocen como
síndrome troglobiomórfico, y pueden observarse de forma convergente en
bastantes grupos zoológicos, a menudo dispares entre sí (Deharveng y Bedos 2018). La
adquisición del síndrome troglobiomórfico casi siempre implica la imposibilidad
de sobrevivir fuera del medio subterráneo, y suele ser una vía evolutiva sin
retorno. Las especies troglobiontes que habitan terrenos volcánicos tienen una
particular capacidad de dispersión, dado que tanto el MSP de las lavas
compactas como las distintas variantes de MSS están ampliamente extendidos y a
menudo interconectados. Solamente los terrenos muy antiguos colmatados de
arcilla y los depósitos de nube ardiente y otros terrenos impermeables suponen
una barrera subterránea para la dispersión de estas especies (Oromí y Martín 1992).
Antecedentes de estudio de la fauna cavernícola en el
archipiélago
La fauna hipogea acuática de Canarias, y en particular la
anquialina (con intromisión de agua marina), ya fue tema de estudio desde
finales del siglo XIX (Koelbel 1892) y ha proseguido con grandes avances
hasta nuestros días (Martínez
et al. 2016). Sin embargo, el medio
subterráneo terrestre no se comenzó a prospectar hasta la década de 1980,
cuando se describió el hemíptero redúvido Collartida anophthalma Español
y Ribes, 1983, la primera especie troglobionte canaria conocida (Español y
Ribes 1983). A partir de esa fecha se creó
el Grupo de Investigaciones Espeleológicas de Tenerife (GIET) en la Universidad
de La Laguna, que abordó de forma continuada la prospección de cuevas
terrestres y el estudio de su fauna, atribuyéndose el descubrimiento de la
mayoría de especies canarias cavernícolas hoy conocidas (Oromí y
Martín 1990). Su actividad biospeleológica
la desarrollaron sobre todo en las islas de Tenerife, La Palma y El Hierro,
gracias sobre todo a un proyecto LIFE-NATURE (1999-2001) que supuso un gran
avance en el conocimiento de la fauna subterránea de estas islas. Miembros del
GIET también iniciaron la prospección del MSS, describieron un nuevo tipo
propio de terrenos volcánicos (Oromí
et al. 1986), y demostraron la
existencia de troglobiontes en zonas (e incluso islas como La Gomera) sin
cuevas ni MSP accesible (Medina y
Oromí 1990).
Posteriormente se formó un grupo espeleológico en La Palma
con gran actividad de exploración de cuevas, cuyo estudio faunístico liderado
por Rafael García ha proporcionado un profundo conocimiento de la biota
subterránea de esa isla (García et al. 2007). La escasez de tubos volcánicos en Gran Canaria relegó
durante mucho tiempo la prospección subterránea en la isla, hasta que miembros
de la Sociedad Entomológica Canaria Melansis iniciaron el estudio de minas
artificiales, algunas de las cuales permitían el acceso al MSS de tipo aluvial,
antes desconocido en Canarias (Naranjo
et al. 2009; Ortuño
et al. 2013); su tarea, junto con el
mayor énfasis puesto por el GIET en el estudio del MSS local usando un tipo de
trampa diseñada para ello (ver López y Oromí 2010), han acabado por desvelar a esta isla como la segunda más
rica del archipiélago en especies troglobiontes (Naranjo
et al. 2020).
Para el estudio de las arañas troglobiontes que iban
apareciendo en el medio subterráneo canario, estos equipos científicos buscaron
colaboración con aracnólogos que describieron nuevas especies (Ribera et al. 1985;
Ribera y Blasco 1986; Wunderlich 1992; Barrientos
et al. 2018) o que iniciaban estudios
sistemáticos y filogenéticos más profundos, sobre todo con especies de las
familias Dysderidae (Ribera y Arnedo 1994; Arnedo
et al. 2007) y Pholcidae (López-Mercader
2005;
Dimitrov y Ribera 2007).
Faunística y diversidad de arañas troglobiontes en
Canarias
El orden Araneae es uno de los grupos más diversos y
abundantes entre los invertebrados depredadores, y juegan un papel fundamental
en las redes tróficas de los ecosistemas de todo el mundo (Schmitz
et al. 2000). Se estima que existen
más de 50 000 especies de arañas descritas hasta la fecha (World Spider Catalog 2023), de las cuales
se estima que 1000 habitan el medio subterráneo (Mammola e Isaia 2017). También es uno de los
grupos animales que mejor ha conseguido adaptarse a la vida hipogea, y tras los
coleópteros son el orden con mayor diversidad de especies troglobiomórficas,
encontrándose en casi todos los medios subterráneos habitados del mundo (Mammola e Isaia 2017;
Deharveng y Bedos 2018). Las arañas
troglobiontes desempeñan un importante papel ecológico en el medio subterráneo
como depredadoras y por las adaptaciones funcionales que poseen (Cardoso 2012). Éstas han adquirido una serie de
adaptaciones morfológicas (despigmentación de la cutícula, reducción ocular,
alargamiento de los apéndices, incremento de la espinación) y fisiológicas
(reducción del metabolismo, alteración de los ritmos circadianos, desarrollo
más lento y tardío, reducción de la fecundidad con huevos de mayor tamaño, pero
en menor número) (Mammola e Isaia 2017) que les han permitido
colonizar y adaptarse al medio subterráneo.
En Canarias las arañas son un orden de artrópodos muy
diversificado, con un total de 544 especies (334 endémicas) representadas por
42 familias (Banco de Datos de Biodiversidad de Canarias 2022),
aunque su diversidad real está probablemente infraestimada (Wunderlich 2011). En el caso de las arañas
troglobiontes, se conocen 39 especies que se encuentran en diferentes hábitats
del medio subterráneo: cuevas y minas (31 spp.), MSS (13 spp.) y depósitos
piroclásticos (3 spp.), distribuidas en todas las islas del archipiélago excepto
Lanzarote (Tabla 1; Fig.
1).
Tabla 1. Relación de
localidades donde se han encontrado arañas troglobiontes según el tipo de
hábitat subterráneo: cuevas, minas, MSS y depósitos piroclásticos de Canarias.
Los números hacen referencia a la localización de estos lugares en la Figura 1.
Table 1. List of the troglobiont spiders present in different subterranean
habitats: caves, mines, MSS and pyroclastic deposits from the Canary Islands.
The numbers refer to the location following the map from Figure 1.
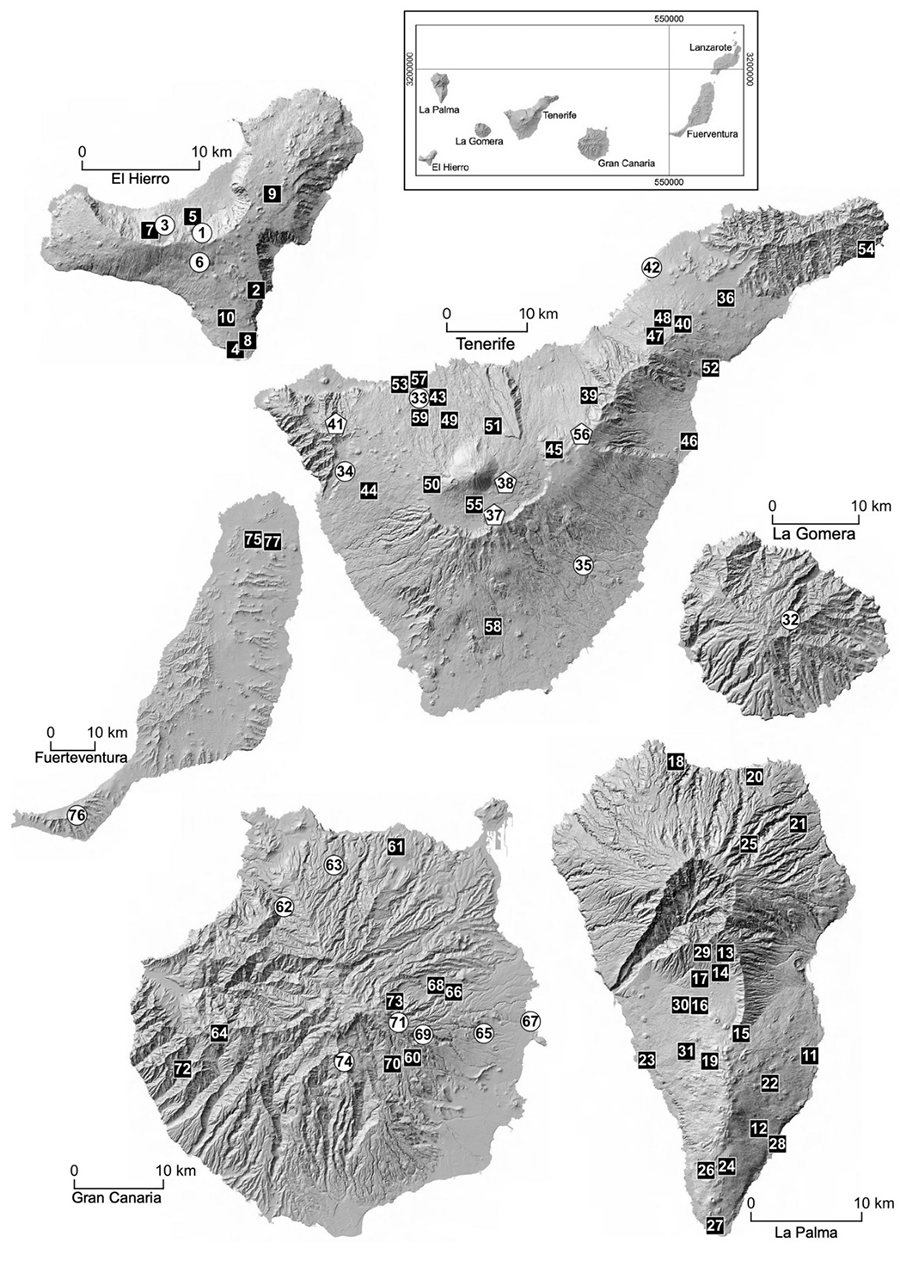
Figura 1. Representación de las localidades
recogidas en la Tabla 1, en las que se han
colectado arañas trogobiontes. Los números hacen referencia a las localidades
de la Tabla 1. Cuadrados negros: cuevas y minas;
Círculos blancos: MSS; Pentágono blanco: depósitos de piroclastos.
Figure 1. Representation of the localities from Table 1 where troglobiont spiders
has been collected. The numbers refer to the location following Table 1. Black squares: caves and mines; White circles: MSS; White
pentagons: pyroclastic deposits.
A continuación, se comentan las familias y géneros de arañas
troglobiontes que tienen mayor diversidad en el archipiélago canario.
El género Dysdera Latreille, 1804 es de considerable
importancia en Canarias por haber experimentado una de las radiaciones
evolutivas más notables en el archipiélago. Con 47 especies endémicas descritas
hasta la fecha, es el género de arañas con mayor riqueza de especies de
Canarias (Macías-Hernández
et al. 2016), y el de mayor número de
especies troglobiontes del archipiélago, con un total de 10 especies descritas
y otras tres aún inéditas (Tabla 2). La isla de
Tenerife ostenta la mayor riqueza, con ocho especies, seguida de Gran Canaria
con dos especies aún sin describir, una en La Palma, y otra en El Hierro
también por describir. Todas estas especies se han encontrado en cuevas, bien
naturales o artificiales, pero cinco de ellas han aparecido además en MSS y dos
de ellas en piroclastos. Estudios filogéneticos de este género (Arnedo
et al. 2007) han revelado que todas
las especies troglobiontes excepto dos (D. esquiveli Ribera y Blasco,
1986 (Fig. 2A) y D. hernandezi Arnedo
y Ribera, 1999) tienen su especie hermana epigea, por lo que la adaptación al
medio subterráneo se ha podido producir a partir de diez procesos
independientes de colonización del mismo. Aparentemente el origen de estas
especies podría deberse a la búsqueda de un refugio climático en el subsuelo
por parte de las poblaciones epigeas, de acuerdo con la hipótesis clásica del
relicto climático (Barr 1968; Barr y Holsinger 1985), frente a la hipótesis
del cambio adaptativo, aplicable sobre todo a especies hipogeas tropicales (Howarth 1987). Sin embargo, el hecho de que tanto las
especies troglobiontes como sus hermanas epigeas se solapen en sus rangos de
distribución, sugiere que la aparición de nichos vacíos, seguido de aislamiento
ecológico, ha propiciado la aparición de estas especies troglobiontes. Otra
peculiaridad es que las arañas de este género presentan diferentes grados de
reducción ocular, elongación de apéndices y desarrollo de uñas tarsales, siendo
Dysdera unguimmanis Ribera, Ferrández y Blasco 1985 la que presenta un
troglomorfismo más acentuado (Fig. 2B). Como
también ocurre en otros organismos, estos diferentes estadios del
troglomorfismo no están directamente relacionados con la edad del taxón (Oromí et al. 1991). Por el
contrario, parecen depender de adaptaciones a las particularidades ambientales
de los distintos hábitats del ecosistema subterráneo (Arnedo
et al. 2007).
También ha sido ampliamente estudiada en Canarias por su
elevada endemicidad la familia Pholcidae, cuyos géneros Pholcus Walckenaer,
1805 y Spermophorides Wunderlich, 1992 han sufrido notables
procesos de diversificación dentro del archipiélago, con 19 y 17 especies
endémicas respectivamente (López-Mercader
2005;
Dimitrov y Ribera 2007). En el medio
subterráneo también se ve reflejado este proceso de diversificación, con hasta
siete especies troglobiontes; dos de ellas del género Pholcus en
Tenerife, y cuatro de Spermophorides en Fuerteventura (p.e. Spermophorides
fuertecavensis Wunderlich 1992 Fig. 2C),
Gran Canaria, Tenerife y La Palma (Tabla 2). A
pesar de mostrar muchas de ellas cierto grado de reducción ocular (Dimitrov y Ribera 2007;
Wunderlich 1992; Wunderlich
1999), solo Pholcus corniger Dimitrov y Ribera, 2006 carece
completamente de ojos. Un elemento destacable dentro de Pholcidae es Ossinissa
justoi (Wunderlich, 1992) (Fig. 2D),
especie de un género monoespecífico endémico de Canarias, que habita en cuevas
de la isla de El Hierro, la más joven del archipiélago.
Los linífidos son también una familia de gran importancia
para la fauna troglobionte canaria, con nueve especies repartidas en cinco
géneros (Centromerus Dahl, 1886, Lepthyphantes Menge, 1866,
Metopobactrus Simon, 1884, Troglohyphantes Joseph, 1882 y Walckenaeria
Blackwall,1859) (Tabla 2). Algunas de estas
especies pueden llegar a ser localmente abundantes en cuevas, como Troglohyphantes
oromii (Ribera y Blasco 1986) en Tenerife (Fig. 2E)
y Troglohyphantes roquensis Barrientos y Fernández-Pérez, 2018 en
Gran Canaria (Tabla 2; Fig. 1). También lo es Walckenaeria subterranea Wunderlich,
2011, que aparece en abundancia en trampas de MSS en Gran Canaria. Especial
mención merece Centromerus fuerteventurensis Wunderlich 1992, una
especie hasta ahora exclusiva de Fuerteventura que ha aparecido recientemente
en muestras de MSS de Gran Canaria, aunque estudios genéticos deberán confirmar
si se trata realmente de la misma especie.
Otras familias incluyen también troglobiontes, aunque con
menor diversidad de especies. La familia Gnaphosidae está representada en
Canarias por una única especie recientemente descrita Poecilochroa exoculata
Lissner 2024 (Lissner et al. 2024) (Tabla 2; Fig. 1;
Fig. 2F). Esta nueva especie está ampliamente
distribuida por el subsuelo de Gran Canaria, carece de ojos y presenta cierto
grado de despigmentación (Naranjo et al. 2009).
De la familia Liocranidae hay dos especies, Agraecina canariensis Wunderlich,
1992 (Fig. 2G) y Agraecina n. sp. aún por
describir, encontrada en el MSS de La Gomera (Tabla 2;
Fig. 1). Agraecina canariensis es la
única araña troglobionte endémica presente en más de una isla, citada en
Tenerife y Gran Canaria (Tabla 2; Fig. 1), aunque estudios genéticos en marcha
probablemente indiquen que son taxones distintos. Esta especie presenta el
tamaño ocular variable, desde individuos con ligera reducción ocular hasta
microftalmos (Wunderlich 1992).
La familia Nesticidae cuenta hasta la fecha con un único
troglobionte descrito, Canarionesticus quadridentatus Wunderlich, 1992 (Fig. 2H) perteneciente a un género considerado
endémico de Tenerife, aunque recientemente se ha hallado otra especie distinta
en el MSS de La Gomera (Tabla 2). Zimirina
grancanariensis Wunderlich, 1992 es el único representante troglobionte de
la familia Prodidomidae, y se encuentra solamente en la isla homónima. Los
únicos Theridiidae canarios de adaptación subterránea son dos especies del
género Robertus O. Pickard-Cambridge, 1879 pendientes de describir (C.
Ribera com. pers.) de El Hierro y La Palma (Oromí
et al. 2001), y una especie anoftalma
de Pholcomma Thorell, 1869 capturada en MSS en El Hierro, afín a P.
gibbum (Westring, 1851) aunque probablemente distinta dado el normal
desarrollo ocular de esta última (J. Lissner com. pers.). Finalmente, la
familia Symphytognathidae, de la que en Europa se conoce una sola especie en
Portugal (Cardoso y Scharff
2009), está
únicamente representada en Canarias por una especie sin describir del género Anapistula
Gertsch, 1941, colectada con trampas de MSS en un terreno de cultivo
abandonado en Tenerife.
Eidmannella pallida (Emerton, 1875) no ha sido
incluida en este catálogo por tratarse de una araña cosmopolita distribuida en
áreas tropicales y subtropicales, que ha sido accidentalmente introducida por
actividades relacionadas con la producción agrícola, invernaderos, viveros y
ambientes similares (Mammola
et al. 2018a), aunque es frecuente
encontrarla en cuevas de Madeira, Canarias y el sur de la Península Ibérica (C.
Ribera, com. pers.). En Canarias ha sido encontrada en todas las
islas excepto Lanzarote y Fuerteventura (Banco de
Datos de Biodiversidad de Canarias 2022).
Tabla 2. Listado de
arañas troglobiontes presentes en el medio subterráneo de Canarias. Los números
hacen referencia a las localidades de la Tabla 1.
Table 2. List of troglobiont spiders distributed in the subterranean
environment from the Canary Islands. The numbers refer to the location
following Table1.

Figura 2. Habitus de varias arañas
troglobiontes presentes en Canarias. (A) Dysdera esquiveli (F.
Dysderidae). (B) Dysdera unguimmanis (F. Dysderidae). (C) Spermophorides
fuertecavensis (F. Pholcidae). (D) Ossinissa justoi (F. Pholcidae).
(E) Troglohyphantes oromii (F. Linyphiidae). (F) Poecilochroa
exoculata. (F. Gnaphosidae). (G) Agraecina canariensis (F.
Liocranidae). (H) Canarionesticus quadridentatus (F. Nesticidae). Fotos:
P. Oromí (A - E, G - H) y M. Naranjo (F).
Figure 2. Habitus of some troglobiont spiders from the Canary Islands. (A)
Dysdera esquiveli (F. Dysderidae). (B) Dysdera unguimmanis (F.
Dysderidae). (C) Spermophorides fuertecavensis (F. Pholcidae). (D) Ossinissa
justoi (F. Pholcidae). (E) Troglohyphantes oromii (F. Linyphiidae).
(F) Poecilochroa exoculata. (F. Gnaphosidae). (G) Agraecina
canariensis (F. Liocranidae). (H) Canarionesticus quadridentatus (F.
Nesticidae). Photographs by P. Oromí (A - E, G - H) and M. Naranjo (F).
Diversidad de arañas troglobiontes en archipiélagos
oceánicos
La biota de cualquier isla oceánica siempre tiene carencias
de taxones respecto a las áreas continentales, fenómeno conocido como
disarmonía insular (Taylor
et al. 2019). Ello se debe a la
dificultad e incluso imposibilidad de muchas plantas y animales de alcanzar y/o
colonizar una isla. La radiación adaptativa puede compensar en parte la baja
biodiversidad inicial, originando una elevada proporción de endemismos locales,
pero raramente llega a igualarse con los valores alcanzados en un área
continental semejante. La ausencia de determinados grupos taxonómicos en islas
es, en parte, consecuencia de la limitada capacidad de dispersión de los mismos
(Gillespie y Roderick 2002). Evidentemente,
las arañas están sujetas a este mismo fenómeno, y los casos de ausencia de
determinadas familias en islas son frecuentes, ya que las que tienen mayor
capacidad de dispersión (ballooning) podrán alcanzar más fácilmente
islas oceánicas y esta característica va a determinar, en gran medida, el
ensamblaje de las comunidades insulares (Gillespie
et al. 2012; Malumbres-Olarte
et al. 2021; Suárez et al. 2023). En
el medio subterráneo se produce también el fenómeno de disarmonía, ya que hay
familias muy representadas en el medio epigeo que no son capaces de colonizar
el subsuelo, y otras que se han adaptado totalmente a la vida subterránea y ya
no habitan el medio epigeo (Cardoso 2012). Las arañas hipogeas, al igual que otros
troglobiontes, no pueden colonizar nuevas islas dada la imposibilidad de
subsistir fuera del medio subterráneo. Ello implica que en Canarias todas las
especies hipogeas estrictas sean endemismos monoinsulares (Oromí
et al. 2021). Algunos casos de
presencia de troglobiontes en dos o más islas (v. gr. Agraecina canariensis en
Tenerife y Gran Canaria) probablemente se deban a la existencia de especies
crípticas no identificadas.
Canarias destaca por una alta diversidad de artrópodos
troglobiontes (225 especies), de los cuales 39 son arañas (17.3%) (Oromí
et al. 2021). Esta riqueza contrasta
con los datos existentes para otros archipiélagos oceánicos: Reunión (3
especies troglobiontes totales/1 araña), Cabo Verde (3/2), Madeira (8/2),
Azores (18/2), Galápagos (18/7) y Hawái (80/14) (Naranjo et al. 2020) (Tabla 3). Estas diferencias
en diversidad pueden deberse a varios factores. Por un lado, las
particularidades geológicas, edáficas y climáticas de cada archipiélago (Oromí
y Afonso Carrillo 2010), factores que
difieren respecto a los que determinan la diversidad de la fauna epigea. En el
caso del medio subterráneo, la edad de las rocas en superficie es más
importante que la edad geológica de la isla, siendo los terrenos más recientes
los que poseen mayor abundancia de subsuelos óptimos para generar un medio
hipogeo habitable (Oromí y
Martín 1992). Otro de los factores a tener
en cuenta es la diferencia del esfuerzo de muestreo invertido en estudiar la
fauna subterránea en las diferentes islas y archipiélagos.
Si tenemos en cuenta la representación por familias de
arañas en estos archipiélagos oceánicos (Canarias, Madeira, Azores, Cabo Verde,
Reunión, Hawái y Galápagos), la más diversa y abundante es la familia
Linyphiidae (21 especies), seguida de Dysderidae (13 spp., todas exclusivas de
Canarias), Pholcidae (9 spp.), Theridiidae (8 spp.), el resto de familias solo
tienen entre 1 y 4 especies hipogeas obligadas (Tabla 3).
Tabla 3. Número de
arañas troglobiontes presentes en Canarias y otros archipiélagos oceánicos.
Table
3. Number of troglobiont spiders from the Canary
Islands and several oceanic archipelagos.
En Canarias la diversidad de artrópodos troglobiontes varía
entre las distintas islas: Tenerife (82), Gran Canaria (57), La Palma (48), El
Hierro (29), La Gomera (17) y Fuerteventura (13) (Oromí
et al 2021). En el caso concreto de las arañas, Tenerife es también la que
alberga mayor número de especies troglobiontes (19), seguida de Gran Canaria
(8), La Palma (4), El Hierro (4), La Gomera (2), y Fuerteventura (2), patrón
similar al observado con el total de artrópodos troglobiontes.
Las cuevas que albergan mayor número de especies de arañas
troglobiontes son Viento-Sobrado (11 spp. / 5 de Dysdera), Felipe
Reventón (10/5) y Labrada (9/5), todas ellas de Tenerife, siendo además las
cavidades con mayor diversidad de artrópodos hipogeos obligados en el
archipiélago. Las estaciones de MSS más ricas en arañas han resultado ser la de
Los Berrazales (4/1) y la del Draguillo (3/1), ambas de Gran Canaria (ver Tabla 2).
Amenazas y conservación de la fauna cavernícola
El medio subterráneo es de especial fragilidad dadas sus
características extremas, con ausencia de luz solar y baja disponibilidad de
recursos energéticos, que influyen en la escasez de organismos y sus
respectivas abundancias (Culver y Pipan
2010). En consecuencia, la fauna adaptada a vivir en estas condiciones es
muy frágil ante perturbaciones de este peculiar hábitat.
Este medio depende en gran medida del medio epigeo, del cual
proviene la mayor parte de la energía (materia orgánica, detritus, deposición
de guano, etc.); de esta forma, las alteraciones producidas en el exterior
afectan también, en mayor o menor medida, al medio hipogeo (Mammola
et al. 2019). A nivel mundial,
algunas de las principales amenazas que perturban al medio subterráneo son la
introducción de especies invasoras y sus patógenos asociados, el cambio
climático, la sobreexplotación de sus recursos biológicos, la contaminación, la
deforestación, la urbanización, las actividades agrícolas e industriales y, en
algunos casos, el impacto del turismo (Mammola
et al. 2022).
El rápido aumento de la concentración atmosférica de gases
de efecto invernadero es uno de los principales componentes del cambio global
que contribuye a la actual crisis de biodiversidad (Chapin
et al. 2000). Aunque estos efectos
negativos son obvios en el medio epigeo, su impacto en el medio subterráneo ha
sido poco estudiado. El medio subterráneo se
caracteriza por poseer unas condiciones constantes de humedad y temperatura a
lo largo del año con escasas fluctuaciones, por lo que futuros incrementos de
temperatura y consecuente desecación de los hábitats terrestres pueden afectarle
negativamente (Mammola
et al. 2018b; Sánchez-Fernández et al. 2021). Las especies troglobiontes pueden tener grandes
limitaciones fisiológicas para tolerar las eventuales fluctuaciones de
temperatura en el medio subterráneo (Pallarés et al. 2020); esto, unido a su baja
capacidad de dispersión y limitado rango de distribución, hace que futuros
escenarios de calentamiento global puedan afectar negativamente a las poblaciones de troglobiontes debido a la pérdida de
hábitat, incrementando el riesgo de extinción de especies endémicas, sobre todo
las insulares dado su limitado rango de distribución (Mammola
et al. 2018b).
Aunque no existen estudios
concretos sobre la afección del aumento de temperatura en la fauna subterránea
de Canarias, a lo largo de los últimos 30 años se está llevando a cabo la toma
de datos ambientales de varias cuevas en el Parque Nacional del Teide para
relacionarlos con posibles variaciones en su composición faunística (J.L.
Martín, com pers.). Se ha observado que durante este periodo la
temperatura media del aire ha ascendido un grado, aumento que puede estar también afectando a la fauna del medio subterráneo (Oromí et al. 2018), aunque futuros estudios
son necesarios para conocer con más detalle dichas alteraciones.
Del listado propuesto por Mammola
et al (2022) sobre las principales amenazas que perturban al medio
subterráneo, en Canarias tenemos constancia del efecto de algunos de ellos en
los ambientes subterráneos que llevamos estudiando desde hace décadas.
Contaminación por aguas residuales
La urbanización sobre las cuevas,
con la consiguiente contaminación por vertido de aguas residuales, es una
amenaza actual en algunas cuevas de Canarias, como la Cueva del Viento-Sobrado
en Icod de los Vinos (Tenerife). Este municipio carece de una red de
saneamiento adecuada de modo que las aguas residuales se filtran al interior de la cueva o incluso vierten
directamente en ella. El mal olor en algunas de sus galerías (p.e. Breveritas Superior,
Sobrado inferior, Piquetes, La Candelaria y Belén) muestra que están claramente
contaminadas por aguas negras, y la más grave
(Piquetes) tiene incluso acúmulo de lodos fecales (Oromí y Socorro 2021). En un proyecto
LIFE-Natura (1999-2001) sobre la biodiversidad y conservación de las cuevas en
las islas de Tenerife, La Palma y El Hierro,
se incluyó un proyecto para la implementación de un sistema de depuración de
aguas residuales en Icod de Los Vinos, instalación que nunca se llegó a
realizar (Oromí y Socorro 2021). A pesar de que el
complejo de Cueva del Viento-Sobrado cuenta con un plan de Ordenación de
Recursos Naturales para evitar edificaciones sobre la cueva y vertidos de
diferentes orígenes, nunca se han implantado dichas medidas para su
conservación. Si la problemática del filtrado de aguas residuales no se
resuelve con celeridad, el futuro de las poblaciones de troglobiontes que habitan estas cuevas está seriamente amenazado (Oromí et al. 2001). Pholcus
corniger fue hallada en un muestreo rápido de un tubo volcánico descubierto
al perforar un pozo negro bajo una casa en construcción, obra que luego fue
finalizada; no se conoce ninguna otra cueva en el municipio de San Miguel
(Tenerife), la localidad típica de esta especie ha desaparecido y su situación
se desconoce por completo. La Cueva del Llano en
Villaverde (Fuerteventura), que alberga el opilión Maiorerus randoi Rambla
1993 considerado como “En peligro de
extinción” en el Catálogo Nacional de Especies
Amenazadas (MARM 2011), discurre bajo un
terreno cada vez más invadido por nuevas construcciones que tampoco disponen de
red de saneamiento, y las autoridades locales no hacen nada por impedirlo a
pesar de las protestas conservacionistas (Menéndez 2018).
Especies introducidas o invasoras
Otra amenaza del medio subterráneo es el desplazamiento de
especies no nativas o invasoras hacia el interior de las cuevas, bien por la
búsqueda de refugios ante el aumento de la temperatura exterior, o debido a la
alteración de los hábitats que se encuentran sobre las cuevas. Aunque
desconocemos casos con arañas, hay evidencias de desplazamiento de especies
troglobiontes por otras foráneas en el medio subterráneo, como ocurre con las
cucarachas Loboptera subterranea Martín y Oromí, 1987 en la Cueva
del Viento-Sobrado (Tenerife) y Loboptera ombriosa Martín e Izquierdo,
1987 en la Cueva de Don Justo (El Hierro) tras la invasión de Periplaneta
australasiae (Fabricius, 1775). La especie troglófila Eidmannella
pallida, de distribución cosmopolita, se ha expandido de forma notable en
hábitats subterráneos de gran parte del mundo, y ha sido considerada en algunos
lugares como una especie exótica invasora que puede estar afectando a la fauna
troglobionte (Melic
et al. 2015), aunque no hay estudios
al respecto. Dysdera crocata C.L. Koch, 1838, catalogada como exótica
invasora en la Macaronesia (Cardoso et al. 2008), ha
sido encontrada esporádicamente en el interior de algunas cuevas en Tenerife y
La Palma, aunque se desconoce su posible impacto y repercusión en la fauna
hipogea endémica.
Visitas de cuevas
Las actividades recreativas y
turísticas en el interior de las cuevas también se han señalado como una
posible amenaza a la biodiversidad de troglobiontes, siendo la principal causa del declive de poblaciones de
las arañas Anapistula ataecina Cardoso y Scharff, 2009 y Turinyphia
cavernicola Wunderlich, 2008 en Portugal (Cardoso
y Scharff 2009; Borges et al. 2016). En Canarias, el acceso
a muchas de las cuevas está restringido por la presencia de rejas en sus
entradas, y en el caso de cuevas turísticas (p.e. Cueva del Viento-Sobrado en Tenerife,
Cueva de Los Verdes en Lanzarote), la zona
accesible al público no coincide con zonas donde habitan las especies troglobiontes. En cambio, y aunque no se trata de un arácnido del orden
Araneae, es importante destacar que en la Cueva del Llano (Fuerteventura) el
recorrido turístico está peligrosamente cercano a la zona donde se encuentra el
opilión Maiorerus randoi, Rambla, 1993.
Grado de amenaza y conservación de la fauna de arañas
A pesar de la importancia
y diversidad de las arañas en los ecosistemas, se ha dado poca trascendencia a
su conservación. A nivel europeo (sin incluir la Macaronesia), solo hay una
especie incluida en el Convenio de Berna y en la Directiva Hábitat, y 178
especies están incluidas en algún catálogo o lista roja en 19 países europeos (Milano et al. 2021). En Canarias no existe ninguna especie de araña incluida en el Catálogo
Canario de Especies Protegidas (CC AA de Canarias 2010),
aunque se incluye el opilión Maiorerus randoi considerado como “En
peligro de extinción” en el Catálogo Nacional de Especies Amenazadas (MARM 2011). En cuanto a las arañas troglobiontes, en todo
el mundo hay siete especies catalogadas con algún nivel de amenaza según la
lista Roja de la Unión Internacional para la Conservación de la Naturaleza
(UICN), cuatro de las cuales se encuentran en la Macaronesia (IUCN 2022). Los archipiélagos
Macaronésicos (Azores, Madeira y Canarias) no han sido incluidos en trabajos
previos sobre fauna y estado de conservación de arañas europeas (Mammola y Isaia 2017; Milano et al. 2021; Mammola et al. 2022) debido a que la insularidad y los procesos
evolutivos derivados del aislamiento han influido en la diversidad regional de
dichos archipiélagos (Malumbres-Olarte
et al. 2021). En el caso de Canarias, no existe ninguna
especie de araña catalogada según los criterios UICN, pero un estudio
preliminar donde se evaluó el grado de amenaza de 23 especies de Dysdera
en Tenerife, sugiere que ocho especies troglobiontes tienen algún grado de
amenaza (González 2021, datos sin publicar). A pesar de las limitaciones que supone
implementar los criterios de la UICN a los invertebrados
y ecosistemas insulares o particulares como las cuevas (Cardoso
et al. 2011), es importante
hacer un esfuerzo para catalogar el grado de amenaza de estas especies troglobiontes con unos criterios
comparables a otros grupos de especies subterráneas y establecer propuestas
para su conservación.
Conclusiones y perspectivas futuras
En este trabajo queda constancia de la gran diversidad de
arañas hipogeas presentes en Canarias, siendo el segundo grupo con mayor número
de especies troglobiontes en las islas. En los últimos 40 años la fauna
subterránea de Canarias ha sido bastante estudiada, con varios grupos de
investigación pioneros en el descubrimiento y conocimiento de nuevas cavidades
y otros hábitats subterráneos, en los que han aparecido nuevas especies para la
ciencia, revelando unas cifras de troglobiontes muy altas en comparación con
otros archipiélagos oceánicos. La mayor parte de la diversidad de arañas
troglobiontes ha sido descrita en las décadas de los 80 y 90, principalmente
por Jörg Wunderlich y Carles Ribera, y más recientemente por Miquel Arnedo y
José Antonio Barrientos entre otros. A medida que aumenta la prospección en
otros tipos de hábitats subterráneos menos estudiados, como las minas
artificiales o el MSS, se observa que una gran parte de la diversidad de arañas
troglobiontes aún está por describir (8 especies nuevas hasta la fecha).
Como perspectivas futuras dentro del estudio de la fauna de
arañas hipogeas, convendría describir estos nuevos taxones, incluir información
genética de todas las especies troglobiontes, recabar información de sus rasgos
funcionales para entender el ensamblaje de las comunidades en el medio
subterráneo (p.e. Cardoso 2012), y realizar
estudios filogeográficos de especies ampliamente distribuidas en el medio
subterráneo para entender los patrones de colonización y flujo génico en este
hábitat. Muchas de estas iniciativas están en marcha y supondrán una mejora en
el conocimiento general de las arañas troglobiontes de Canarias.
En cuanto a la conservación,
sería interesante recabar información sobre la distribución de las especies
troglobiontes, y evaluar el grado de amenaza de estas especies en base a
criterios de la UICN y del Gobierno de Canarias, para establecer
futuras propuestas para su conservación. Para las especies que se
encuentran amenazadas o están próximas a hacerlo, convendría incluirlas en los
Programas de Seguimiento de Especies Amenazadas de Canarias (SEGA) llevados a
cabo por la Viceconsejería de Medio Ambiente del Gobierno de Canarias (Rodríguez
González et al. 2013). También habría
que llevar a cabo estudios de seguimiento a lo largo del tiempo, así como
fomentar estudios faunísticos, de historia natural y evaluación de sus
poblaciones, ya que hay un déficit de conocimiento acerca de los hábitats
subterráneos y de la posible afección del cambio climático sobre los mismos. También se han de tomar medidas de conservación
en las cuevas de especial interés biológico, proveyendo el área donde se
encuentran de un sistema de saneamiento adecuado e instalando rejas en las
entradas para evitar el acceso (Oromí et al. 2001).
Algunas cavidades volcánicas (p.e. Cueva Viento-Sobrado en
Tenerife y Cueva de las Palomas en La Palma) están incluidas entre los Lugares
de Interés Comunitario (LIC) de Canarias, otras están localizadas dentro de la
Red de Espacios Naturales Protegidos de Canarias y, en general, las cuevas no
explotadas turísticamente están citadas como uno de los hábitats naturales
incluidos en el Anexo I de la Directiva de Hábitats de Canarias; sin embargo,
no existe una legislación específica de protección especial para las mismas. En
este sentido, ya existen iniciativas a nivel mundial para promover la inclusión
de los hábitats subterráneos dentro de las futuras políticas de conservación y
agendas de cambio climático (Sánchez-Fernández
et al. 2021; Wynne
et al. 2021).
Además, es necesario fomentar la educación medioambiental y
la divulgación sobre el medio subterráneo, como las visitas turísticas guiadas
y controladas o charlas divulgativas de diferente índole, prensa escrita y
redes sociales, para acercar a la sociedad en general y divulgar las
particularidades de estos hábitats y la fauna que los habita. Finalmente,
debemos mejorar la comunicación entre científicos y gestores de la
biodiversidad a nivel local y regional, para poder llevar a cabo medidas de
protección y conservación adecuadas en el medio subterráneo.
Contribución de los autores
NMH: Conceptualización, Redacción - borrador original,
Redacción – revisión y edición. DS: Redacción - borrador original, Redacción –
revisión y edición. SCL: Redacción – revisión y edición, Visualización. HL:
Redacción – revisión y edición. PO: Redacción - borrador original, Redacción –
revisión y edición, Visualización.
Agradecimientos
Agradecemos a Jørgen Lissner, Antonio J. Pérez, Carles
Ribera y Manuel Naranjo por la cesión de datos, información y préstamo de
fotografías. A los revisores José Antonio Barrientos y Miquel Arnedo por sus
aportaciones para la mejora del manuscrito. A los Cabildos de las diferentes
islas por facilitarnos los permisos necesarios para los estudios y la colecta
de la fauna subterránea. A todos los biólogos y espeleólogos que han colaborado
y trabajado en los diferentes proyectos para el estudio de la fauna subterránea
de Canarias.
Referencias
Ancochea, E., Hernán, F., Huertas,
M.J., Brändle, J.L., Herrera, R. 2006. A new chronostratigraphical and evolutionary model for La Gomera:
implications for the overall evolution of the Canarian Archipelago. Journal
of Volcanology and Geothermal Research 157: 271-293.
Arnedo, M.A., Oromí, P., Múrria, C., Macías-Hernández, N., Ribera, C.
2007. The dark side of an island radiation: systematics and evolution of
troglobitic spiders of the genus Dysdera Latreille (Araneae: Dysderidae)
in the Canary Islands. Invertebrate Systematics 21: 623-660.
Banco de
Datos de Biodiversidad de Canarias 2022. Disponible
en: https://www.biodiversidadcanarias.es/biota/ [Accedido el 19/12/2022]
Barr, T.C. 1968. Cave ecology and the evolution of troglobites. Evolutionary
Biology 2: 35-102.
Barr, T.C.,
Holsinger, J.P. 1985. Speciation in cave faunas. Annual
Review of Ecology and Systematics 16: 313-337.
Barrientos, J., Pérez, J.F., Morales, M.N. 2018. Un nuevo Troglohyphantes
Joseph, 1881 (Araneae, Linyphiidae) de las Islas Canarias (España). Revista
Ibérica de Aracnología 3-10.
Borges, P., Crespo, L.,
Cardoso, P. 2016. Species conservation profile of the cave
spider Turinyphia cavernicola (Araneae, Linyphiidae) from Terceira
Island, Azores, Portugal. Biodiversity Data Journal 4: e10274-e10274.
Cardoso, P. 2012. Diversity and community assembly patterns of epigean vs.
troglobiont spiders in the Iberian Peninsula. International Journal of
Speleology 41: 9-9.
Cardoso,
P., Scharff, N. 2009. First record of the spider
family Symphytognathidae in Europe and description of Anapistula ataecina
sp. n. (Araneae). Zootaxa 2246: 45-57.
Cardoso, P., Borges, P.A.V., Macías-Hernández, N. 2008. Dysdera crocata C.L. Koch, 1838. En:
Silva, L. Ojeda Land, E., Rodríguez Luengo, J. (eds.), Invasive terrestrial
flora and fauna of Macaronesia. TOP 100 in Azores, Madeira and Canaries,
pp. 415-417. ARENA, Ponta Delgada, Açores.
Cardoso, P., Borges, P.A.V.,
Triantis, K.A., Ferrández, M.A., Martín, J.L. 2011. Adapting
the IUCN Red List criteria for invertebrates. Biological Conservation
144: 2432-2440.
Carracedo, J.C.,
Day, S.J., Guillou, H., Rodriguez, E., Canas, J.A., Perez, F.J. 1998. Origen y
evolución del volcanismo de las Islas Canarias. En Ciencia y Cultura en
Canarias, pp. 165-165. OACIMC, Santa Cruz de Tenerife.
Chapin, F.S., Zavaleta, E.S., Eviner, V.T., Naylor, R.L., Vitousek, P.M.,
Reynolds, H.L., Hooper, D.U. et al. 2000. Consequences of changing
biodiversity. Nature 405: 234-242.
Comunidad
Autónoma de Canarias. 2010. Ley 4/2010, de 4 de
junio, del Catálogo Canario de Especies Protegidas. BOE 150, 53388-53406.
Culver, D.C.,
Pipan, T. 2010. Climate,
abiotic factors, and the evolution of subterranean life. Acta Carsologica
39: 539-577.
Culver, D.C.,
Pipan, T. 2019. The biology of caves and other
subterranean habitats. Oxford University Press.
Deharveng,
L., Bedos, A. 2018. Diversity of terrestrial
invertebrates in subterranean habitats. En Cave ecology, pp. 107-172.
Springer.
Dimitrov,
D., Ribera, C. 2007. The genus Pholcus
(Araneae, Pholcidae) in the Canary Islands. Zoological Journal of the
Linnean Society 151: 59-114.
Español, F.,
Ribes, J. 1983. Una nueva
especie troglobia de Emesinae (Heteroptera, Reduviidae) de las Islas Canarias. Speleon
26: 57-60.
García, R., Fernández, O., Martín, M.A., González, A.I., Dumpiérrez, F.,
Ferraz, A.I., González, E.R. et al. 2007. Estudio de las cavidades
volcánicas del Parque Nacional de la Caldera de Taburiente: aspectos
topográficos, geomorfológicos, arqueológicos y biológicos. Ed. Organismo
Autónomo de Parques Nacionales. Madrid, España.
Gillespie, R.G.,
Roderick, G.K. 2002. Arthropods on Islands: Colonization,
Speciation and Conservation. Annual Review of
Entomology 47: 595-632.
Gillespie, R.G., Baldwin, B.G., Waters, J.M., Fraser, C.I., Nikula, R.,
Roderick, G.K. 2012. Long-distance dispersal: a
framework for hypothesis testing. Trends in Ecology & Evolution 27:
47-56.
Howarth, F.G. 1983. Ecology of cave arthropods. Annual
Review of Entomology 28: 365-389.
Howarth, F.G. 1987. The evolution of non-relictual troglobites. International
Journal of Speleology 16: 1-16.
Howarth, F.G. 1996. A comparison of the ecology and evolution of cave-adapted faunas
in volcanic and karstic caves. En Proceedings 7th Int. Symp.
Vulcanospeleology, Sta. Cruz La Palma, Spain., pp. 63-68. Libros de la Frontera, Sant Cugat del Vallés.
IUCN. 2022. IUCN Red List of
Threatened Species. Disponible en: https://www.iucnredlist.org/es.
[Accedido el 20-12-2022]
Juberthie, C. 1983. Le milieu
souterrain: étendue et composition. Mémoires de
Biospéologie 10: 17-65.
Juberthie, C., Delay, B., Bouillon, M. 1980. Sur l’existence d’un milieu
souterrain superficiel en zone non calcaire. Comptes
Rendues Académie Sciences (Paris) Série D 290:
49-52.
Koelbel, K. 1892. Beiträge zur Kenntnis der Crustaceen der Canarischen Inseln. Annalen
des naturhistorischen Museums in Wien 7: 105-116.
Lissner, J., Suárez, D.,
López, H. 2024. A new eyeless Poecilochroa Westring,
1874 (Araneae: Gnaphosidae) from Gran Canaria, Spain. Arachnology 19:
1018-1024.
López, H.,
Oromí, P. 2010. A type of trap for sampling the
mesovoid shallow substratum (MSS) fauna. Speleobiology Notes 2: 7-11.
López-Mercader,
N. 2005. Evolutionary processes of the genus Spermophorides
(Araneae, Pholcidae) in the Canary Islands. Tesis de Doctorado. Universitat de Barcelona, España.
Macías-Hernández, N., de la Cruz López, S., Roca-Cusachs, M., Oromí, P., Arnedo,
M.A. 2016. A geographical distribution database of the
genus Dysdera in the Canary Islands (Araneae, Dysderidae). ZooKeys 625: 11-23.
Malumbres-Olarte, J., Rigal, F.,
Girardello, M., Cardoso, P., Crespo, L.C., Amorim, I.R., Arnedo, M., et al. 2021. Habitat
filtering and inferred dispersal ability condition across-scale species
turnover and rarity in Macaronesian island spider assemblages. Journal of
Biogeography 48: 3131-3144.
Mammola, S.,
Isaia, M. 2017. Spiders in caves. Proceedings of
the Royal Society B: Biological Sciences 284:(1853), 20170193.
Mammola, S.,
Giachino, P.M., Piano, E., Jones, A., Barberis, M.,
Badino, G., Isaia, M. 2016. Ecology and sampling techniques of an understudied
subterranean habitat: the Milieu Souterrain Superficiel (MSS). The Science
of Nature 103: 88-88.
Mammola, S.,
Cardoso, P., Ribera, C., Pavlek, M., Isaia, M. 2018a.
A synthesis on cave-dwelling spiders in Europe. Journal
of Zoological Systematics and Evolutionary Research 56: 301-316.
Mammola, S.,
Goodacre, S.L., Isaia, M. 2018b. Climate change may
drive cave spiders to extinction. Ecography 41: 233-243.
Mammola, S.,
Piano, E., Cardoso, P., Philippe, V., David, D.-V.,
Isaia, M. 2019. Climate change going deep: the effects of global climatic
alterations on cave ecosystems. The Anthropocene
Review 6: 98–116.
Mammola, S., Meierhofer, M.B., Borges, P.A., Colado, R., Culver, D.C.,
Deharveng, L., Delić, T. et al. 2022. Towards evidence-based
conservation of subterranean ecosystems. Biological Reviews 97:
1476-1510.
MARM (Ministerio de
Medio Ambiente y Medio Rural y Marino). 2011.
Real Decreto 139/2011, de 4 de febrero, para el desarrollo del Listado de
Especies Silvestres en Régimen de Protección Especial y del Catálogo Español de
Especies Amenazadas. BOE, 46, 20912-20951.
Martín, J.L., Oromi, P.,
Barquín, J. 1985. Estudio ecológico del ecosistema
cavernícola de una Sima de Origen volvanico: La Sima Robada (Tenerife, Islas
Canarias). Boletín de la Asociación Española de Entomología 8: 265-270.
Martínez, A., Gonzalez, B., Núñez, J., Wilkens, H., Oromí, P., Iliffe, T.,
Worsaae, K. 2016. Guide to the anchialine ecosystems of Los Jameos del Agua
and Túnel de la Atlántida. Cabildo de Lanzarote.
Medina,
A.L., Oromí, P. 1990. First
data on the superficial underground compartment on La Gomera (Canary Islands). Mémoires de Biospeologie 17: 87-91.
Melic, A., Barrientos, J.A., Morano, E., Urones, C. 2015. Orden
Araneae. Revista IDE@-SEA 11: 1-13.
Menéndez, S. 2018. La Urbanización Casilla de Costa es una amenaza para la
Cueva del Llano. Diario de Fuerteventura 21: 4-5.
Milano, F., Blick, T., Cardoso, P., Chatzaki, M., Fukushima, C.S.,
Gajdoš, P., Gibbons, A.T., et al. 2021. Spider
conservation in Europe: a review. Biological Conservation 256: 109020.
Montoriol, J.
1973. Sobre la tipología
vulcanoespeleológica. Com. III Simp. Espeleologia, Mataró 268-272.
Naranjo, M., Oromí, P., Pérez, A.J., González, C., Fernández, O., López,
H., Martín, S. 2009. Fauna cavernícola de Gran Canaria. Melansis y Caja
Insular de Ahorros de Gran Canaria.
Naranjo, M., López, H., Martín, S., Suárez, D.B., Oromí, P. 2020. Troglobiontes
de Gran Canaria. Vida bajo el volcán. Troglobionts of Gran Canaria, life under
the volcano. CAMPDS Eds. Las Palmas de Gran Canaria.
Oromí,
P., Afonso Carrillo, J. 2010. La fauna
subterránea de Canarias: un viaje desde las lavas hasta las cuevas. Volcanes:
mensajeros del fuego, creadores de vida, forjadores del paisaje. Instituto de
Estudios Hispánicos de Canarias, Puerto de la Cruz 63-98.
Oromí, P.,
Martín, J.L. 1990. Recorrido histórico y
perspectiva actual de la espeleología en Canarias. Actas Facultad Ciencias
la Universidad de La Laguna, Tomo Homenaje T. Bravo.
Oromí, P.,
Martín, J.L. 1992. The
Canary Islands. Subterranean fauna, characterization and composition. En:
Camacho, A.I. (ed.), The natural history of biospeleology, pp. 680-680. C.S.I.C.,
Madrid.
Oromí, P.,
Socorro, S. 2021. Biodiversity in the Cueva del
Viento Lava Tube System (Tenerife, Canary Islands). Diversity 13: 226.
Oromí, P., Medina, A.L., Tejedor, M.L. 1986. On
the existence of a superficial underground compartment in the Canary Islands. En: Acta IX Congreso Internacional de Espeleología, Barcelona,
pp. 147-151.
Oromí, P., Martín, J.L., Medina, A.L., Izquierdo, I. 1991. The evolution of the hypogean fauna in the Canary Islands. En:
Dudley, E.C. (ed.), The unity of evolutionary biology, pp. 380-395. Dioscorides
Press, Portland, OR.
Oromí, P., Zurita, N., Muñoz, E., de la Cruz, S. 2001. Conservación
de la fauna invertebrada cavernícola de las islas de Tenerife, El Hierro y La
Palma. Universidad de
La Laguna (informe sin publicar, depositado en Consejería Política Territorial
y Medio Ambiente, Gob. Canarias) pp. 394.
Oromí, P., Pérez, A.J., Martín, J.L., Martín, N. 2018. La fauna
subterránea, pobladora de un hábitat inhóspito. En: N. Martín, P. Oromí, A.J.
Pérez (Eds.). Legados del Fuego. Reservorios de una asombrosa biota y
refugios ancestrales, pp. 82-131. Ayuntamiento de La Orotava. La Orotava,
Santa Cruz de Tenerife, España.
Oromí, P., Arechavaleta, M.A., de la Cruz, S., García, R., Izquierdo,
I., López, H., Macías-Hernández, N., et al. 2021. Diversidad faunística en
el medio subterráneo volcánico, con especial énfasis en las Islas Canarias. Boletín
de la Sociedad Española de Espeleología y Ciencias del Karst: SEDECK 25-50.
Ortuño, V.M., Gilgado, J.D., Jiménez-Valverde, A., Sendra, A.,
Pérez-Suárez, G., Herrero-Borgoñón, J.J. 2013. The
“alluvial mesovoid shallow substratum”, a new subterranean habitat. PLoS One
8: e76311.
Pallarés, S., Sánchez-Hernández, J.C., Colado, R., Balart-García, P.,
Comas, J., Sánchez-Fernández, D. 2020. Beyond survival
experiments: using biomarkers of oxidative stress and neurotoxicity to assess
vulnerability of subterranean fauna to climate change. Conservation
Physiology 8: coaa067.
Pipan, T., López, H., Oromí, P., Polak, S., Culver, D.C. 2010.
Temperature variation and the presence of troglobionts in terrestrial shallow
subterranean habitats. Journal of Natural History 45: 253-273.
Ribera,
A., Blasco, A. 1986. Araneidos cavernícolas de
Canarias. I. Vieraea 16: 1-48.
Ribera,
C., Arnedo, M.A. 1994. Description
of Dysdera gollumi (Araneae, Haplogynae), a new troglobitic species from
Tenerife, Canary Islands, with some comments on Canarian Dysdera. Mémoires de Biospeologie 21:
115-119.
Ribera, C., Ferrández, M.A., Blasco, A. 1985. Araneidos cavernícolas de
Canarias II. Mémoires de Biospéologie 12: 51-66.
Rodríguez
González, Z., Martín Sánchez, M., Díaz Fumero,
A.C., Acosta Álvarez, J.C., Fernández Gallardo, M., Rodríguez Bermúdez, M.A.,
Carqué Álamo, E., et al. 2013. Actuaciones en especies amenazadas de las Islas
Canarias incluidas en la Red Natura 2000. Conservación Vegetal 17:
19-25.
Sánchez-Fernández, D., Galassi, D.M., Wynne, J.J., Cardoso, P., Mammola, S. 2021. Don’t forget subterranean ecosystems in climate change agendas. Nature
Climate Change 11: 458-459.
Schmitz, O.J., Hambäck, P.A., Beckerman, A.P. 2000. Trophic cascades in
terrestrial systems: a review of the effects of carnivore removals on plants. The
American Naturalist 155: 141-153.
Suárez, D., Arribas, P.,
Macías-Hernández, N., Emerson, B.C. 2023. Dispersal
ability and niche breadth influence interspecific variation in spider abundance
and occupancy. Royal Society Open Science 10: 230051.
Taylor, A.,
Weigelt, P., König, C., Zotz, G., Kreft, H. 2019. Island disharmony revisited
using orchids as a model group. New Phytologist 223: 597-606.
Uéno, S.I. 1980. The anophthalmic trechine beetles of the group of Trechiama
ohshimai. Bulletin of the National Science Museum Tokio Series A 6:
195-274.
World
Spider Catalog. 2023. World
Spider Catalog. Natural History Museum Bern. versión 21.0. Disponible
en: https://wsc.nmbe.ch/.
[Accedido el 20 octubre 2022].
Wunderlich, J. 1992. Die
Spinnen-fauna der Makaronesischen Inseln. Beiträge zur Araneologie 1:
1-619.
Wunderlich, J. 1999. Eine
bisher unbekannte cavernicole Art der Zitterspinnen von la Palma, Kanarische
Inseln (Arachnida: Araneae: Pholcidae). Entomologische
Zeitschrift 109: 71-73.
Wunderlich, J. 2011. Extant and fossil spiders (Araneae). Beiträge zur
Araneologie 6: 1-640.
Wynne, J.J., Howarth, F.G., Mammola, S., Ferreira, R.L., Cardoso, P.,
Lorenzo, T.D., Galassi, D.M.P., et al. 2021. A conservation roadmap for
the subterranean biome. Conservation Letters 14: e12834.
![]() , Daniel Suárez2,3,4
, Daniel Suárez2,3,4 ![]() , Salvador de la Cruz-López4
, Salvador de la Cruz-López4 ![]() , Heriberto López2,4
, Heriberto López2,4 ![]() , Pedro Oromí1,4
, Pedro Oromí1,4 
